下列叙述正确的是( )
| A.常温常压下,17g羟基中所含电子数为9NA |
| B.常温下,1 molFe与足量浓硝酸反应,转移2 NA个电子 |
| C.常温常压下,22.4L的NO2 和CO2混合气体含有2 NA个O 原子 |
| D.在1L0.1 mol/L碳酸钠溶液中,阴离子总数小于0.1 NA |
在一定条件下,可逆反应X(g)+3Y(g)  2Z(g)。达到平衡时,有50%的Y转化为Z,若X的转化率也为50%,则起始时充入容器中的X与Y的物质的量之比为
2Z(g)。达到平衡时,有50%的Y转化为Z,若X的转化率也为50%,则起始时充入容器中的X与Y的物质的量之比为
| A.1∶1 | B.1∶3 | C.2∶3 | D.3∶2 |
在恒温条件下,向CH3COONa稀溶液中分别加入少量下列物质:其中可使比值
c(CH3COO-)/c(Na+)增大的是
A.固体NaOH B固体KOH.
C. 相同浓度的 CH3COONa稀溶液 D. 氯化钠固体
0.1 mol/L CH3COONa稀溶液中,下列离子浓度关系不正确的是
| A. c(Na+) + c(H+) = c(CH3COO-)+ c(OH-) |
| B. c(Na+) >c(CH3COO->c (OH-)>c(H+) |
| C. c(CH3COO- )+ c(CH3COOH)=" 0.1" mol/L |
| D. c(Na+)>c(CH3COO--)>c (H+)>c(OH-) |
能大量共存于溶液中的离子组有
| A. Al3+、Na+、AlO2-、NO3-、Cl- |
| B. Cl-、HCO3-、OH-、Na+、SO42- |
| C. Ba2+、OH-、Cl-、K+、NO3- |
| D. Fe2+、H+、Na+、NO3-、SO42- |
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是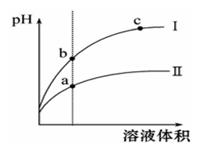
| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点KW的数值比c点KW的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |