某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为,Y在周期表中的位置是 ,
Z单质的化学式为。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为、X与Y组成的分子式为_______。
(1)写出下列反应的化学方程式:
①铝热反应(铝粉与四氧化三铁):;
②铜片与过量的浓硫酸共热:;
(2)写出下列反应的离子方程式:
③铵盐溶液与烧碱溶液共热:;
④铜片与浓硝酸反应:。
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 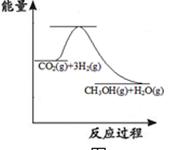
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是(填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是(填:a或b);
0—8min内该反应的平均速率v(CO2)=mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
只用一种试剂来鉴别下列各组物质:
(1)甲醇、乙醛、乙酸,选用的试剂是。
(2)乙酸、甲酸甲酯、乙酸乙酯,选用的试剂是。
(3)苯、四氯化碳、1—已烯、苯酚的水溶液,选用的试剂是。
丙烯可用于合成是杀除根瘤线虫的农药B(分子式为C3H5Br2Cl),该分子中每个碳原子上均连有卤原子,其合成路线如下图所示。
(1)丙烯的结构简式是 ,它含有的官能团名称是。
,它含有的官能团名称是。
(2) 由A生成B的反应类型是。
由A生成B的反应类型是。 (3)A水解可得到 CH2=CHCH2OH,该水解反应的化学方程式为:。
(3)A水解可得到 CH2=CHCH2OH,该水解反应的化学方程式为:。