(14分)高铁酸盐在能源、环保等方面有着广泛的用途。高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。替代传统的净水剂及Cl2对淡水进行净化消毒是城市饮用水处理新技术。
工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解NaOH溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是 。
(2)用异丙醇代替水洗涤产品的好处是 。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 , 。
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。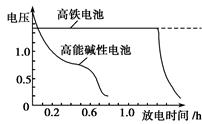
(5)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0 mmol·L-1(1 mmol·L-1=10-3 mol·L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。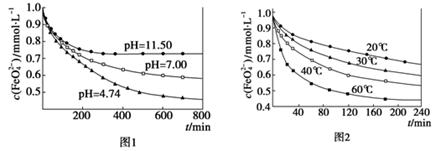
[实验2]将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于20 ℃、30 ℃、40 ℃和60 ℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A~F六种元素原子,原子半径最大的是▲(填序号);
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:▲;
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:▲;
(4)用A元素的单质和C元素的单质可制成新型的化学电源,其构造如图所示。2个电极均由多孔性碳制成,通入气体由孔隙中逸出,并在电极表面放电,b电极电流流出。
①a是▲极,电极反应式为▲
②b是▲极,电极反应式为▲
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出五氯化磷在某条件下自身电离的方程式:
▲(一种为正四面体阳离子,另一种为正八面体阴离子)。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是▲。
| A.HSO3- | B.NH4+ | C.OH- | D.HCO3- E.CH3COO- F.Cl- |
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体)碱(电子对给予体)反应产物
H+ + [∶OH ]—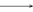 H∶OH
H∶OH
试指出下列两个反应中的酸或碱
①H3BO3 + H2O = H++ B(OH)4- 该反应中的碱是▲(填:H3BO3或 H2O)
②BF3+ NH3 = BF3· NH3该反应中的酸是▲(填:BF3或 NH3)
有一种稀有气体化合物六铂氟酸氙XePtF6。研究报告指出:“关于XePtF6的电价有Xe2+[ PtF6]2—、Xe+[ PtF6]— 两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入PbF可得到PbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答:
(1)XePtF6中各元素的化合价分别是▲、▲、▲。
(2)XePtF6是▲(离子、共价)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式▲。而且O2与PtF6可发生类似反应,其反应式是▲。
取3.320g只含羧基,不含其它官能团的固态芳香族羧酸置于4L氧气中,经点燃,羧酸完全燃烧,反应后气体体积增加了0.224L,将气体通过足量的固体Na2O2后,体积减少1.792L(所有体积均在标准状况下测定)。请回答:
(1)3.320g该羧酸中碳元素的物质的量为_______________mol。
(2)该羧酸中C、H、O的原子个数比为____________________。
(3)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式__________。
0.1mol CmHnCOOH与Br2完全加成时需Br2 16g,0.1mol该有机物完全燃烧时产生CO2和H2O的物质的量之和为3.5mol,试通过计算确定该有机酸的结构简式。