有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
回答下列有关问题:
(1)通入空气的电极为 (写电极名称)。燃料电池中阳离子的移动方向 (“从左向右”或“从右向左”)。
(2)电解池中产生20 mol Cl2,理论上燃料电池中消耗 mol O2。
(3)a、b、c的大小关系为: 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池放电时正极反应式是 。
已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见的化合物,Y的摩尔质量数值比Z的小16,乙、丙的摩尔质量相同,B的摩尔质量比D的小2,B、X的摩尔质量相同,各物质转化关系如下:
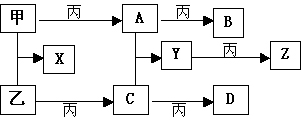 |
1、写出下列有关物质化学式:丙_________;B _________。
2、写出Y→Z反应化学方程式__________________________。
A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
 |
1.写出B、D形成化合物电子式__________________。
2.写出下列有关物质化学式:E ___________, J _____________。
3.写出C单质与H水溶液反应的离子方程式___________________。
今有H2、Cl2混合气体100 mL(标准状况),其中一种气体体积为45 mL,另一种气体为55 mL,光照使两种气体发生反应后,恢复到标准状态,气体体积为______mL。为了证明反应后气体中H2和Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标准状态,若
(1)剩余__________mL气体,证明有__________剩余,理由是____________________。
(2)溶液有__________性质,证明有__________剩余,理由是____________________。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下列工艺流程生产单质碘。完成下列问题: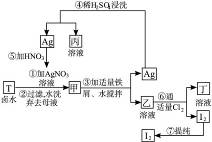
(1)写出乙、丁中溶质的化学式:乙___________,丁___________。
(2)第④步操作中用稀硫酸浸洗的目的是___________。
a.除去未反应的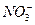
b.除去未反应的I-
c.除去未反应的Fe
d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是___________和___________(不要求写具体步骤)。
(4)实验室检验I2的方法是_________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示):______________________。
(提示:3Ag+4HNO3====3AgNO3+NO↑+2H2O)
(6)按上述实验过程填空: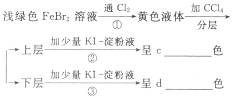
写出①②③反应的化学方程式。
①____________________________________________________________________;
②____________________________________________________________________;
③____________________________________________________________________。
已知I2+H2S====2HI+S。把Cl2缓慢通入到一含有I-、Br-、S2-(三者浓度相同)的溶液中,首先析出的是_________,最后析出的是_________。
(2)取2 g铝粉和3 g碘小心混匀,均分为四份。分别加0.5 g水,1 g胆矾,1 g无水硫酸铜,1 g明矾。加水的一份首先冒火花,发生剧烈反应,其次是加明矾的一份,而加无水硫酸铜的难发生反应。
①铝和碘发生反应的化学方程式为___________________________。
②铝和碘反应看到的现象是____________________________________。
③四份混合物发生反应的先后顺序说明:
a. ______________________________________________________,
b. ______________________________________________________。