(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的△H= ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
(Ⅱ)回答下列问题:
(1)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=____________mol·L-1(填精确值)。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。
A. B.H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。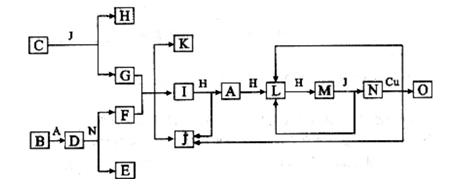
请回答下列问题:
(1)组成B单质的元素位于周期表第___周期,第____族。化合物C的电子式为______。
(2)通常情况下J为液体,用电子式表示其形成过程为_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内平均速率为。
(2)在实验2中,A的初始浓度c2=__________,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”、“=”或“<”),且c3__________1.0mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为;在刹车和下坡时甲电极的电极反应为。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有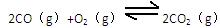
已知:平衡时各物质的浓度关系有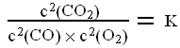 ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编 号 |
c(CO)/ mol/L |
c(O2)/ mol/L |
c(CO2)/ mol/L |
v(正)和v(逆)的比较 |
| Ⅰ |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)= v(逆) |
| Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂
中铁元素的含量。实验步骤如下: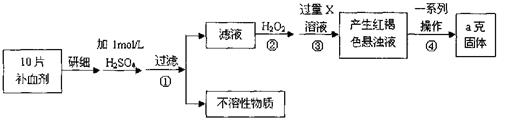
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(4)若实验过程中无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+= 5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②某同学设计的下列滴定方式中,最合理的是(夹持部分略去)(填字
母序号) 
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用
含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含mgFeSO4·7H2O的
片剂。
A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子
是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A同主族;Y元素的最外层电子数是其次外层电子数的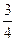 倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
(1)画出Y元素离子的结构示意图;写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式。
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的名称为,该盐的水溶液中各离子浓度由大到小的顺序为。
(3)科学家用D、E、X 三种元素形成的化合物XDE3和X2E,在573K时反应制得了离子化合物X3DE4;经测定X3DE4中各原子的最外层电子都达到了8电子稳定结构,则DE43-的电子式为,X3DE4与水能剧烈反应转化为常见物质,写出反应的化学方程式:。