有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。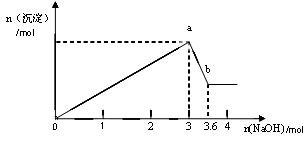
试推断:
(1)该溶液中一定存在__________ ____,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为 。
(3) 写出图中a b变化过程的离子方程式 。
b变化过程的离子方程式 。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol-1
2SO3(g) ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH =−113.0 kJ·mol-1
2NO2(g)ΔH =−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH =kJ·mol-1。
SO3(g)+NO(g)的ΔH =kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。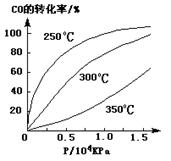
(本题8分)对于反应xA(g)+yB(g)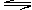 pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
pC(g)+qD(g)压强与温度对C的质量分数的影响如图: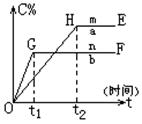
(1)若m、n表示不同温度,则mn,正反应为反应(填“放热”、“吸热”);
(2)若m、n表示不同压强,则mn,(x+y)(p+q)(填<、>、=);
(3)b曲线的OG段比a曲线的OH段陡的原是:;
(4)a曲线的HE段高于b曲线的GF段的原是:。
(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: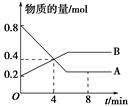
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:。
(2)已知化学键的键能为:
| 化学键 |
H—H |
N—H |
 |
| 键能/( kJ·mol-1) |
436 |
391 |
945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1
2H2(g)+O2(g) 2H2O(l)ΔH=-571.6 kJ·mol-1
2H2O(l)ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为。
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。