工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
| D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 |
Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2
化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的是()
①用电子式表示HCl的形成过程: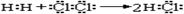 ;
;
②MgCl2的电子式: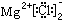 ,
,
③质量数为133、中子数为78的铯原子: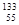 Cs
Cs
④乙烯、乙酸结构简式依次为:CH2CH2、C2H4O2
⑤S2-的结构示意图:
| A.①②③④⑤ | B.④⑤ | C.③④⑤ | D.③⑤ |
下列物质中不属于合成材料的是 ()
| A.塑料 | B.淀粉 | C.合成纤维 | D.合成橡胶 |
下列各组物质不属于同分异构体的是()
| A.葡萄糖和果糖 | B.淀粉和纤维素 | C.蔗糖和麦芽糖 | D.正戊烷和新戊烷 |
下列实验装置或操作不符合实验要求的是() 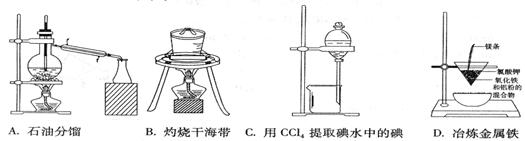
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。下列生产乙醇的反应中,原子利用率最高的是 ()
A.乙烯水化:CH2=CH2 + H2O CH3CH2OH CH3CH2OH |
B.葡萄糖发酵:C6H12O6 2CH3CH2OH + 2CO2 ↑ 2CH3CH2OH + 2CO2 ↑ |
C.溴乙烷水解:CH3CH2Br + H2O CH3CH2OH + HBr CH3CH2OH + HBr |
D.丙酸乙酯水解:CH3CH2COOCH2CH3 + H2O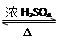 CH3CH2OH + CH3CH2COOH CH3CH2OH + CH3CH2COOH |