人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 .金属以矿物形式存在,下列矿石的主要成分属于氧化物的是 (填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 .
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
| A.固体中一定有Fe、Ag,可能有 Cu、Zn |
| B.固体中一定有Fe、Zn,可能有 Cu、Ag |
| C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+ |
| D.滤液中一定含Zn2+、Fe2+,可能含Cu2+ |
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
请回答:
①操作1的名称是 ;固体A的成分为 .
②若要检验向固体C中加入的稀硫酸是否足量的方法是 .
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和 ..
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题:
(1)t1℃时,三种物质的溶解度从大到小的关系 ;
(2)t2℃时,将30g甲加到50g水中,充分搅拌,可形成 g溶液;
(3)甲中含有少量乙,可采用 方法提纯甲;
(4)将t3℃三种物质的饱和溶液降温到t2℃,所得溶液中溶质的质量分数大小关系是 ;(填字母)
A、甲>乙=丙 B、甲=丙>乙 C、甲>丙>乙

原子序数为3﹣18的元素的原子结构示意图等信息如下,请认真分析并回答下列问题:

(1)表中,X= ;该元素的原子在化学反应中容易 (填“得到”或“失去”)电子;
(2)表中具有相对稳定结构的原子有 ;(填元素符号)
(3)由于氧原子和硫原子的 相同;所以氧元素和硫元素的化学性质相似;
(4)同周期元素,从左往右 依次递增;(写一条)
生活中蕴含着许多化学知识,请用所学知识填空:
(1)我们常用 来检验软水和硬水;
(2)洗涤剂能去油污是利用洗涤剂对油污的 作用;
(3)2017年5月5日,我国自主研发的大型客机C919试飞成功,实现了我国航空领域的新突破。下列标示的材料中属于金属材料的是 ;属于有机合成材料的是 ;

从H、C、N、O、Na、S六种元素中选择适当的元素按照要求填空。
(1)用适当的数字和符号填空:
①两个氢分子 ;②两个钠离子 ;③氧化钠 ;
(2)写出符合下列要求的物质的化学式:
①空气中含量最多的物质 ;②天然存在的最硬的物质 ;
③造成酸雨的气体 (写一种);
④烘焙糕点所用发酵粉的有效成分 ;
(3)写出一条属于复分解反应的化学方程式 ;
实验室制取氧气并进行相关实验。
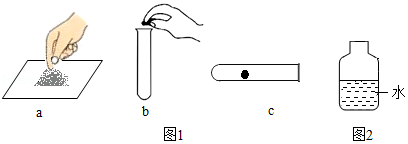
①双氧水和二氧化锰制氧气的化学方程式是 。取用二氧化锰操作正确的是 (选填编号如图1)。
②探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如表:
|
氧气体积分数(%) |
30 |
40 |
60 |
70 |
|
带火星的木条 |
不变 |
稍亮 |
复燃 |
复燃 |
根据上述实验数据得出的结论是 。
在集气瓶中注入占其容器50%的水(如图2所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,推测实验现象并说明理由。
③双氧水分解也可用氧化铜作催化剂。在0.5g氧化铜中滴加双氧水,反应结束后固体仍为0.5g且呈 色。
设计一个实验,证明在双氧水分解反应后,氧化铜化学性质没有发生改变。
|
步骤 |
现象 |
结论 |
|
|
|
氧化铜化学性质没有改变 |