氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。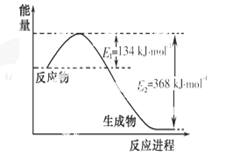
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ • mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ • mol-1
则反应CO(g) + O2(g)=CO2(g)的 △H= kJ • mol-1。
O2(g)=CO2(g)的 △H= kJ • mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a、容器内N2、H2、NH3的浓度之比为1:3:2
b、NH3的浓度保持不变
c、容器内压强保持不变
d、混合气体的密度保持不变
某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O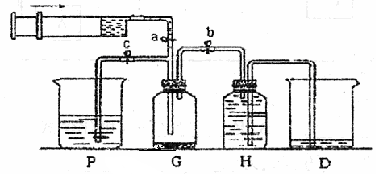
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是。装置P中盛放的试剂是。
(3)尾气处理时关闭弹簧夹a和弹簧夹,打开弹簧夹。
(4)处理尾气时,发生反应的离子方程式为。
填空题(共7分)
(1)SO2到品红溶液,溶液褪色,SO2体现______性。
(2)SO2到酸性高锰酸钾溶液,溶液褪色,SO2体现_____性
(3)SO2到紫色石蕊溶液,溶液变____, SO2体现______性
(4)过量的氯气通到紫色石蕊溶液,溶液先变_____,后_____,最终溶液为
__________色。
在10L的一密闭容器中,用2 mol的A和2 mol的B发生:A(g)+ 2 B(g) 2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为,B在的反应速率 ,平衡时C的体积分数为_______。
2 C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为,B在的反应速率 ,平衡时C的体积分数为_______。
在一定条件下,反应A(气)+B(气) C(气)(正反应为放热反应)达到平衡后,根据下列图象判断:
C(气)(正反应为放热反应)达到平衡后,根据下列图象判断: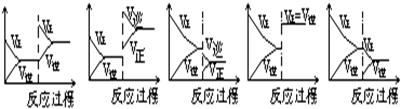
| A. | B. | C. | D.E. |
(1)升温,达到新的平衡的是( );(2)降压,达到新的平衡的是( );(3)减少C的量,移向新平衡的是();(4)增加A的量,移向新平衡的是();(5)使用催化剂,达到平衡的是( )。
在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
⑴该反应化学平衡常数的表达式:K=;
⑵该反应为(填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO) = c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为。