下表是元素周期表的一部分。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 1 |
① |
|
|
|
|
|
|
| 2 |
② |
③ |
④ |
|
|
⑤ |
⑥ |
| 3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为________,此氢化物的还原性比元素⑨的氢化物的还原性________(填“强”或“弱”)。
(2)俗称为“矾”的一类化合物通常含有的共同元素是____________。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的化学方程式_____________________。又如表中与元素⑦的性质相似的不同族元素是____________(填元素符号)。
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区;氟原子的电子排布图为溴原子的价电子排布式为.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A.CsICl2=CsCl+ICl B.CsICl2 ="CsI" +Cl2
(5)ClO2-的空间构型为型,中心氯原子的杂化轨道类型为,写出一个ClO2-的等电子体 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是。
A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3.NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为。
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是(写2点)。
(2)固体混合物A中的成分是。
(3)反应I完成后,铁元素的存在形式为(填离子符号);写出生成该离子的离子方程式。
(4)操作1主要包括:、、。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为.。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显性,原因是(用离子方程式表示)。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②-ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,该官能团的名称是。
(2)上述变化中属于水解反应的是(填反应编号)。
(3)写出结构简式,G:,M:。
(4)写出反应①的化学方程式:。
(5)任写一种符合下列要求的A的同分异构体。
I.含有苯环 II.能发生银镜反应,且能使氯化铁溶液显紫色
III.苯环上的一元取代物只有一种
(1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g),工作原理示意图如下: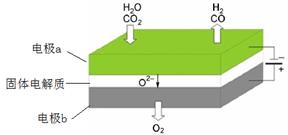
①电极b发生(填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: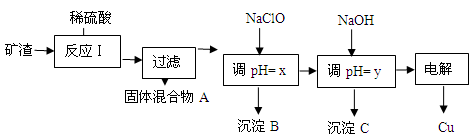
已知: Cu2O + 2H+=" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
①固体混合物A中的成分是。
②反应Ⅰ完成后,铁元素的存在形式为。(填离子符号)
请写出生成该离子的离子方程式。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是。
④下列关于NaClO调pH的说法正确的是(填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为。