向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率v(C)=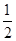 v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了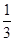 ,B的物质的量减少了
,B的物质的量减少了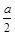 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,v(A)=________。
(2)化学方程式中,x=________、y=________、p=________、q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)反应达平衡时的压强与起始时的压强比 。
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:反应速率________(填“增大”、“减小”或“不变”),理由是_________________;
海藻中富含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图。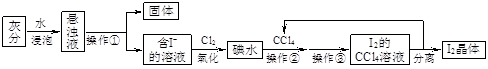
(1)写出操作名称:操作①,操作③。
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的(填仪器名称)中加入少量1mol·L-1 NaOH溶液;
②振荡至溶液的色消失,静置、分层,则(填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的(填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol·L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是。
下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空: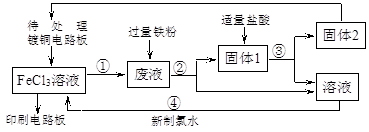
(1)镀铜电路版制成印刷电路版的离子方程式为;固体1的化学成分是(填化学式)。
(2)反应①的化学方程式为;要检验废液中是否含有Fe3+所需的试剂是(填化学式)溶液。
(3)反应④的离子方程式为。
已知氧化还原反应与四种基本反应类型的关系可用如图表示,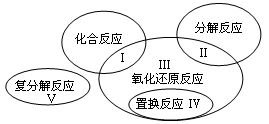
下列是有水参加或生成的几种反应:
①CaO + H2O ==Ca(OH)2
②2Na + H2O ="=" 2NaOH + H2↑
③H2 + CuO 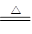 Cu +H2O
Cu +H2O
④3S+6NaOH 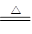 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH + HCl ="=" NaCl + H2O
请回答下列问题:
(1)反应①中水(填字母)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
(2)反应③被氧化的元素是(填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式:。
请分别选用一种试剂除去下列物质中的杂质,并写出相应的离子方程式。
| 物质 |
杂质 |
所选试剂 |
离子方程式 |
|
| ① |
NaCl溶液 |
Na2CO3 |
||
| ② |
Mg粉 |
Al粉 |
按要求写出下列反应的化学方程式:
①将一小块钠投入水中:。
②氢氧化铝与氢氧化钠溶液反应:。
③过氧化钠与水反应:。