如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒。
②乙池中阳极的电极反应式是_______________________。
(2)若两池中均为饱和NaCl溶液:
①甲池中碳极上电极反应式是________________________,乙池碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
②将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为_________。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=___。
A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: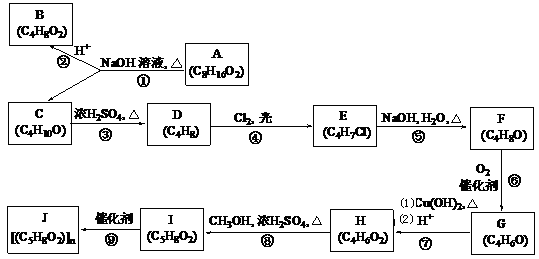
(1)①的反应类型是_______________,③的反应类型是_______________;
(2)B和C均为有支链的有机化合物, C在浓硫酸作用下加热反应只能生成一种烯烃D,则C的系统命名为:_______________;A的结构简式为_______________;
(3)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则⑨的化学方程式为_______________;
(4)H同分异构体中含有“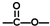 ”结构的链状化合物共有________种;写出(i)能发生水解反应
”结构的链状化合物共有________种;写出(i)能发生水解反应
(ii)能使溴的四氯化碳溶液褪色(iii)能发生银镜反应(iv)核磁共振氢谱峰面积之比为3∶2∶1,同时满足这四个条件的同分异构体的结构简式:_______________。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;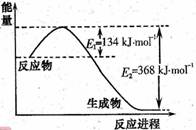
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
| A.容器内混合气体颜色不再变化 |
| B.容器内的压强保持不变 |
| C.v逆(NO2)=v正(NO) |
| D.容器内混合气体密度保持不变 |
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是_____________________________________为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为__________。
(2)为了保护这些纸质文物,有人建议采取如下措施:喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷,生成的氧化锌可以防止酸性腐蚀。用该方法生成氧化锌的化学方程式为__________________。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
① FeTiO3+ C+ Cl2  TiCl4+ FeCl3+ CO
TiCl4+ FeCl3+ CO
② TiCl4+O2 TiO2+2Cl2
TiO2+2Cl2
(4)某新型“纸电池”以碳纳米管和金属锂为两极,造纸用的纤维素在一种离子液体M中溶解作隔离膜,电池工作时的总反应式为xLi+C(碳纳米管) LixC,下列有关说法正确的是
LixC,下列有关说法正确的是
| A.放电时Li+由正极向负极移动 |
| B.充电池的阳极反应式为LixC-xe-= xLi++ C |
| C.M可能为羧酸、醇等含活泼氢的有机物 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④X的最外层电子数是其电子层数的2倍;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)Z元素在元素周期表中的位置为_________,化合物WY的电子式为_______________________________。
(2)实验室用 WX2与饱和食盐水来制某种气态有机化合物,反应的化学方程式为
___________________________________________________________________________。
(3)Cu2Z与过量浓硝酸反应有红棕色气体生成,反应的离子方程式为
______________________________________________________________________________。
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。

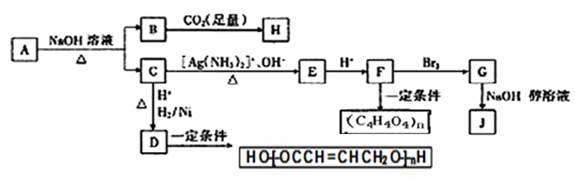
(1)A分子中含有的官能团有 。
C→E的反应方程式为 。
(2)写出由G生成J的反应方程式为 。
(3)由D生成 HO-[-OC CH = CHCH2 O-]-nH的反应类型为 。由F到G的反应类型为 。
(4)A的同分异构体甚多,满足下列条件的A的有同分异构体有 种(不考虑立体异构),
①含苯环,②含羧基,③含醛基,④含碳碳双键。
其中核磁共振氢谱峰面积比是1:2:2:2:1的的是 。