香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示: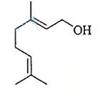
下列有关香叶醉的叙述正确的是
| A.香叶醇的分子式为C10H18O |
| B.不能使溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.能发生加成反应不能发生取代反应 |
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是()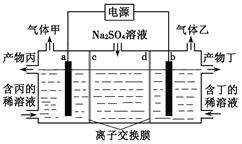
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-= H2↑+2OH- |
全球已经批量生产的混合动力汽车采用镍氢动力电池。常见的镍氢电池某极是储氢合金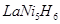 (在反应前后La、Ni的化合价为0),其电池的反应通常表示为:
(在反应前后La、Ni的化合价为0),其电池的反应通常表示为: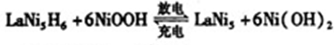
下列有关说法正确的是
| A.放电时电子流入储氢合金电极 |
B.放电时1mol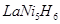 失去6mol电子 失去6mol电子 |
C.放电时正极反应为 |
| D.充电时外接电源的正极应该接在储氢合金的电极上 |
反应N2O4(g) 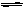 2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是()
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是()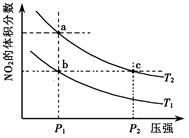
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a浅,c深 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |
在恒容密闭容器中存在下列平衡:

 。
。 的平衡物质的量浓度
的平衡物质的量浓度 与温度T的关系如右图所示。下列说法错误的是()
与温度T的关系如右图所示。下列说法错误的是()
A.反应   的 的 |
B.在 时,若反应处于状态 时,若反应处于状态 ,则一定有 ,则一定有 |
C.平衡状态 与 与 相比,平衡状态 相比,平衡状态 的 的 小 小 |
D.若 时的平衡常数分别为 时的平衡常数分别为 ,则 ,则 |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
| A.以X的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |