现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:(1)将固体NaCl细粒干燥后,准确称出m克NaCl固体并转移到定容仪器a中。(2)用滴定管b向a仪器中滴加某液体c,不断振荡,加至a仪器的刻度线,计算出NaCl固体的体积为Vcm3,再通过NaCl的体积和质量,即可算出阿伏加德罗常数.上述操作中的abc分别指 ( )
| A.容量瓶、酸式滴定管、四氯化碳 | B.容量瓶、碱式滴定管 、苯 |
| C.量筒、碱式滴定管、水 | D.量筒、酸式滴定管、水 |
生活中的一些问题常涉及到化学知识,则下列叙述不正确的是
| A.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| B.明矾和漂白粉常用于自来水的处理,但两者的作用原理不相同 |
| C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,能氧化单质铜 |
| D.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 |
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是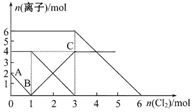
| A.离子的还原性顺序为:Fe2+>I->Br- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
| A.该燃料电池负极发生的电极反应为:N2H4+4OH-−4e-==N2↑+4H2O |
| B.用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 |
| C.该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 |
| D.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
利用自然资源制备相关化学物质,下列化学工艺不可行的是
下列有关实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 硫酸溶液 |
试管口出现红棕色气体 |
溶液中NO3- 被Fe2+还原为NO2 |
| B |
H2S通入CuSO4溶液中 |
溶液中出现黑色沉淀 |
酸性:H2S>H2SO4溶液 |
| C |
在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 |
有白色沉淀生成,苯层呈紫红色 |
白色沉淀可能为CuI |
| D |
将一小块钠投入到CuSO4溶液中 |
有无色无味的气体放出,且出现蓝色沉淀 |
氧化性:H+>Cu2+ |