下列参数比较及解释均正确的是
| 选项 |
参数 |
比较 |
解释 |
| A |
沸点 |
HF<HCl<HI |
组成结构相似的物质,相对分子质量越大沸点越高 |
| B |
半径 |
Na+﹥Al3+﹥S2- |
同一周期粒子半径随原子序数的递增逐渐减小 |
| C |
酸性 |
H2SO3>H2CO3 |
元素的非金属性越强,其含氧酸的酸性越强 |
| D |
还原性 |
P3->S2->Cl- |
元素的非金属性越强,简单阴离子的还原性越弱 |
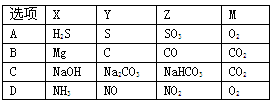
下表各组物质中,物质之间不可能实现如图所示转化的是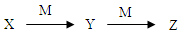
设NA为阿伏伽德罗常数的值。下列说法正确的是
①28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
②1 L 0.1 mol·L-1的氨水中含有NH3·H2O分子数为0.1NA
③1 mol Na2O2固体与足量CO2反应转移电子数为1NA
④标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
| A.4个 | B.3个 | C.2个 | D.1个 |
化学与科学、社会、技术和环境密切相关。下列有关说法中错误的是
| A.目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 |
| B.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| C.CO2、CH4、氟氯代烃等都会造成温室效应,因此都属于大气污染物 |
| D.绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
在通风橱中进行下列实验:
下列说法中不正确的是
| A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2 |
| B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 |
| C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
| D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |