经测定C3H7OH和C6H12组成的混合物中碳的质量分数为78%,则此混合物中氧的质量分
数是( )
| A.8% | B.10% | C.22% | D.18% |
元素周期表是学习化学的重要工具。下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是
| A.该元素的原子序数为6 |
| B.该元素所有原子的质子数均为6 |
| C.该元素的相对原子质量为12.01 |
| D.该元素没有同位素,所有原子的中子数均为6 |
下列四组物质中互为同素异形体的是
| A.纯碱与苏打 |
| B.12CO和14CO |
C.CH3CHO与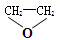 |
| D.金刚石和富勒烯(C60) |
氰酸铵(NH4CNO)与尿素[CO(NH2)2]
| A.互为同系物 | B.互为同分异构体 |
| C.都是共价化合物 | D.都是有机化合物 |
下列说法正确的是
A.H、D、T表示三种氢原子
B.卤族元素最高化合价均为正7价,最低化合价均为负1价
C.金属元素的原子最外层电子数,都少于4个
D.目前人们已发现了5000多种核素,说明发现了5000多种元素
下列化学用语对应正确的是
A.Cl-离子的结构示意图: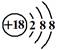 |
B.白磷分子的比例模型: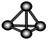 |
| C.H2O2的结构式:H-O-O-H |
D.CCl4的电子式: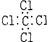 |