下列有关金属腐蚀的叙述正确的是( )
| A.金属化学腐蚀的实质是M-ne-=Mn+,电子直接由氧化剂提供 |
| B.金属在潮湿的空气中腐蚀的实质是M+nH2O=M(OH)n+n/2H2↑ |
| C.金属的化学腐蚀必须在酸性条件下进行,以析出H2为主 |
| D.在潮湿的强酸性环境下,金属的电化学腐蚀主要以正极上析出H2为主 |
下列说法正确的是
| A.H2O和H2O2中的化学键类型完全相同 |
| B.N2的结构式为N—N |
| C.一个D216O分子所含的中子数为10 |
D.NaCl的电子式为 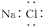 |
下列说法不正确的是
| A.通过煤的干馏可以获得焦炭 |
| B.煤液化后可以得到甲醇 |
| C.从萃取分液后溴的四氯化碳溶液中提取溴可以用分馏的方法 |
| D.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 |
如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的
| a极板 |
b极板 |
X电极 |
乙溶液 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
Cu(NO3)2 |
根据相应的图像(图像编号与答案一一对应),判断下列相关说法正确的是
A.密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
铅蓄电池用途极广,电解液为30% H2SO4溶液,电池的总反应式可表示为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
下列有关叙述正确的是
| A.放电时电解液的密度不断增大 |
| B.放电时电子从Pb通过导线转移到PbO2 |
| C.充电时Pb极与外电源的负极相连 |
| D.充电时PbO2电极发生还原反应,Pb电极上发生氧化反应 |