碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下: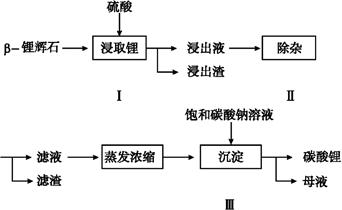
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 。
(5)从母液中可回收的主要物质是 。
工业上由黄铜矿(主要成分
)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的吸收.
a.浓
b.稀
c.
溶液 d.氨水
(2)用稀
浸泡熔渣B,取少量所得溶液,滴加
溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)以
溶液为电解质溶液进行粗铜(含
、
、
、
、
等杂质)的电解精炼,下列说法正确的是.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中
向阳极移动
d.利用阳极泥可回收
、
、
等金属
(5)利用反应
可制备
,若将该反应设计为原电池,其正极电极反应式为 .
难溶性杂卤石(
)属于"呆矿",在水中存在如下平衡
⇌
为能充分利用钾资源,用饱和
溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
(1)滤渣主要成分有和以及未溶杂卤石.
(2)用化学平衡移动原理解释
溶液能溶解杂卤石浸出
的原因:.
(3)"除杂"环节中,先加入溶液,经搅拌等操作后,过滤,再加入溶液调滤液
至中性.
(4)不同温度下,
的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①②;

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生: 已知298 时, =2.80×10﹣9, =4.90×10﹣5,求此温度下该反应的平衡常数 (计算结果保留三位有效数字).
过渡金属催化的新型碳﹣碳偶联反应是近年来有机合成的研究热点之一,如:
反应①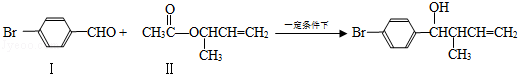
化合物Ⅱ可由化合物Ⅲ合成: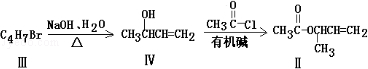
(1)化合物Ⅰ的分子式
(2)化合物Ⅱ与
加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为(注明反应条件),因此,在碱性条件下,由Ⅳ与
反应生成Ⅱ,其反应类型为.
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种).
化合物
(
)在氢氧化钠溶液中加热反应后再酸化可得到化合物
和
.回答下列问题:
(1)
的分子式为
,分子中只有一个官能团.则
的结构简式是,
与乙醇在浓硫酸催化下加热反应生成
,该反应的化学方程式是,该反应的类型是;写出两种能发生银镜反应的B的同分异构体的结构简式.
(2)
是芳香化合物,相对分子质量为180,其碳的质量分数为60.0
,氢的质量分数为4.4
,其余为氧,则
的分子式是.
(3)已知
的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是.另外两个取代基相同,分别位于该取代基的邻位和对位,则
的结构简式是.
(4)
的结构简式是.
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按图所示步骤进行操作.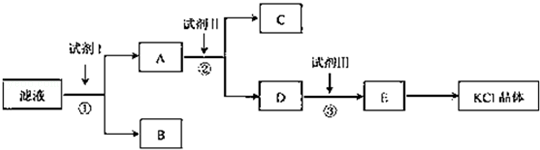
回答下列问题:
(1)起始滤液的pH7(填"大于"、"小于"或"等于"),其原因是.
(2)试剂I的化学式为,①中发生反应的离子方程式为.
(3)试剂Ⅱ的化学式为,②中加入试剂Ⅱ的目的是;
(4)试剂Ⅲ的名称是,③中发生反应的离子方程式为;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol•L﹣1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为.(列式并计算结果)