信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为 ;得到滤渣1的主要成分为 。
⑵第②步加入H2O2的作用是 ,使用H2O2的优点是 ;调节pH的目的是使 生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案: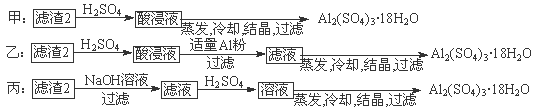
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
下列表示分子结构的图示中,●表示原子序数为1-10的元素的“原子实”(指原子除去最外电子层电子后剩余的部分),周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如F2 。现有A、B、C、D四种分子的结构,回答下列问题
。现有A、B、C、D四种分子的结构,回答下列问题
(1)写出A和C的分子式A C
(2)上述物质中,分子空间结构为正四面体的是(写分子式)
(3)B的沸点比HCl (填“高”或“低”),原因是
(4)写出上述物质中的两种间相互反应生成离子化合物的化学方程式:
水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知H3O+ + OH- = 2H2O,H3O+的立体构型是_________,中心原子的杂
化类型是_______。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是
A、极性键 B、非极性键 C、配位键
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为________ 。
(4)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是
A、金刚石 B、干冰 C、食盐 D、固态氨
(14分)A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
(1)写出四种单质的化学式
A_________ B__________ C______ D________
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为:),静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为(保留到小数点后两位)。
(8分)常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3·H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是。
(4)取10mL⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=mol/L.