铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝: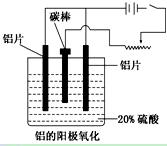
2Al2O3  4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。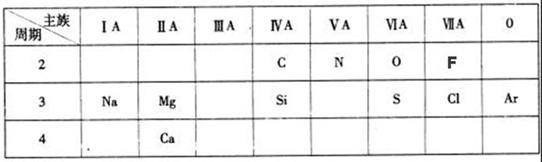
(1)化学性质最不活泼的元素是(填元素名称);
(2)Cl原子结构示意图为;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是(填化学式);
(4)O和N中,原子半径较大的是;
(5)“高钙牛奶”中的钙是指(填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物(填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为;
(9)S元素形成的一种氢化物的化学式是,该物质中H元素与S元素的质量比
m(H):m(S)=。(相对原子质量:H-1S-32)
人们一日三餐的主食由大米、面粉等制作而成,其主要成分是。医疗上常用作“钡餐”的是(填" 硫酸钡”或"碳酸钡")。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
A |
|||||||
| 2 |
D |
E |
K |
G |
||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)表中元素,化学性质最不活泼的是;可用于制半导体材料的元素是_______; 非金属性最强的是。
(2)最高价氧化物的水化物碱性最强的是,该物质的水溶液与C最高价氧化物的水化物反应的离子方程式是
H最高价氧化物的水化物是
(3)由A、K两种元素组成的含10个电子的化合物的结构式是,
B的氧化物的电子式是,该氧化物属于晶体。
(1)下列各组物质中: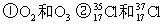 ③H2O和 D2O④ CH3CH3和CH3CH2CH2CH3⑤ CH3-CH2-OH和CH3-O-CH3
③H2O和 D2O④ CH3CH3和CH3CH2CH2CH3⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;______;互为同素异形体是:______;
互为同分异构体是:______。
(2)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有g氧化剂参加反应
下列排列顺序不正确的是
| A.非金属性:F>Cl>S | B.熔点: SiO2>KCl>I2 |
| C.稳定性:HF>H2S>H2O | D.碱性:KOH>NaOH>Al(OH)3 |