材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下: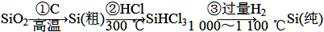
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 |
SiHCl3 |
SiCl4 |
HCl |
| 沸点 |
33.0 ℃ |
57.6 ℃ |
-84.7 ℃ |
在步骤②中提纯SiHCl3所进行的主要操作的名称是________。
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
侯氏制碱法制取纯碱的生产流程如图所示:
某小组同学在实验室模拟该流程制纯碱,设计如下:
可供选择的试剂有:6 mol·L-1盐酸、6 mol·L-1硫酸、浓氨水、生石灰、石灰石、氯化铵、蒸馏水和冰。(夹持仪器略)
请回答:
(1)A装置中所装试剂是和,B装置的作用是。
(2)用相关化学用语说明D装置制取气体的原理。
(3)检验D装置中产生的气体的方法。
(4)根据下表中四种物质的溶解度,回答:
①侯氏制碱是在30 0C左右进行生产的,那么沉淀池中在30 0C时析出的物质X是,分离方法。C装置中反应的化学方程式是。
②依据上表和工业流程图,为了从C装置中分离后的溶液中得到更多的副产品NH4Cl,可采取的措施是。
a.加NH3和NaCl b.通入CO2c.降低温度
(5)C装置中产品X经煅烧得到纯碱,其中常含有少量的NaCl,为测定其纯度,某实验小组设计的以下方案正确的是。
①取纯碱样品a g于试管中,溶解后,加入过量盐酸,用碱石灰吸收产生的气体,碱石灰增重b g。
②取纯碱样品a g于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g。
③取纯碱样品a g于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g。
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3-)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3-)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
②2NO(g)+O2(g)  2NO2(g)ΔH =" -113.0" kJ/mol ;
2NO2(g)ΔH =" -113.0" kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g)ΔH=______ kJ/mol。
2SO3(g)ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第________周期第________族;C的基态原子核外有_________对成对电子;Cl原子的价电子表示式________.
(2)用“>”、“=”、“<”填空
| 稳定性 |
得电子能力 |
离子半径 |
电负性 |
| CH4____NH3 |
1H_____2H |
Na+_____Al3+ |
C____Al |
(3)用电子式表示NaCl的形成过程:__________________________________________.
(4)已知在常温常压下:
| 化学键 |
H—H |
H—Cl |
Cl—Cl |
| 键能kJ/mol |
a |
b |
c |
写出H2与Cl2反应的热化学方程式:_________________________________________.
[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为;D和E的电负性大小关系为(用元素符号表示)。
(2)化合物E2D分子的空间构型为,中心原子采用杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为,任意写出一种它的等电子体的化学式为。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于晶体,晶体内含有的作用力类型有。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为g/cm3。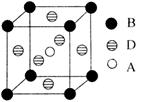
[化学一选修2:化学与技术](15分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: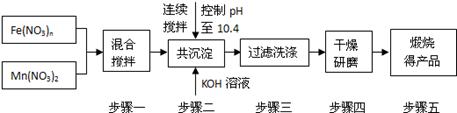
(1)原料Fe(NO3)n中n=,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为。
(2)步骤二中“连续搅拌”的目的是;步骤三中洗涤干净的标准是。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4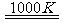 MnFe2O4-x+
MnFe2O4-x+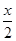 O2↑
O2↑
MnFe2O4+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为。
②该热化学循环法制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是。