如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是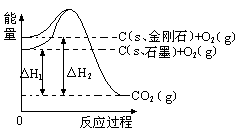
| A.石墨和金刚石的转化是物理变化 |
| B.1mol石墨的总能量比1 mol金刚石的总能量大1.9 kJ |
| C.金刚石的稳定性强于石墨 |
| D.C(s、石墨)=C(s、金刚石) △H=" +1.9" kJ•mol-1 |
下列反应是吸热反应的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙与水反应 |
下列各组元素中原子序数按由大到小顺序排列的是()
A.Be、C、B B.Cl、O、Li C.Al、S、Si D.C、S、Mg
施用碳酸氢铵、氯化铵等铵态氮肥能够促进农作物生长,但是铵态氮肥不能与碱性肥料如草木灰混合使用,其原因是铵态氮肥()
| A.易溶于水 | B.能与碱反应 |
| C.受热易分解 | D.在水中易发生电离 |
下列物质中属于合金的是
| A.黄金 | B.白银 | C.钢 | D.水银 |
从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是
| A.铜和浓硝酸反应 | B.铜和稀硝酸反应 |
| C.氧化铜和硝酸反应 | D.氯化铜和硝酸银反应 |