某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为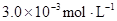 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 |
平衡常数 |
焓变 |
起始总浓度 |
在水中,HA 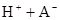 |
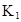 |
 |
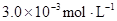 |
在苯中,2HA 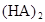 |
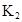 |
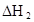 |
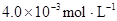 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则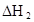 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足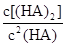 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
(2分)冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法。人类用量处在前三位的金属是铁、铝、铜。(填编号)
(1)冶炼铝用到的方法是;
(2)冶炼铁和铜的常用方法是。
能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量(填“相同”或“不相同”)。
现有:①二氧化碳 ②甲烷 ③二氧化硫 ④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)天然气的主要成分是;
(2)医院化验糖尿病要用到的物质是;
(3)造成温室效应和全球气候变暖的主要物质是;
(4)泄漏到空气中而产生酸雨的主要物质是。
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ _(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加SO3的物质的量 |
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。