(1)某有机物A的质量为9.2克,完全燃烧后生成0.4mol二氧化碳和10.8克水,且此有机物的蒸气的相对密度是相同状况下氢气的23倍,求:
①此有机物的分子式为
②写出该有机物可能的结构简式
(2)某烃B的相对分子质量为84。回答下列问题:
①下列物质与B以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
②若链烃B分子中所有的碳原子共平面,该分子的一氯取代物只有一种, 则B的结构简式为 。
③若烃B不能使溴水褪色,并且其一氯代物只有一种,则B的结构简式为 。
(3)C1(一碳化学)是以含一个碳原子的化合物如:甲烷(CH4)、合成气(CO和H2)、CO2、CH3OH、HCHO等为初始反应物,反应合成一系列重要的化工原料和燃料的化学。
①CO与H2按一定比例可合成乙二醇(C2H6O2),则n(CO)/n(H2)= 。
②汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)= 。(用m 、 n表示)
天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
其平衡常数表达式为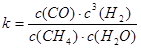 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图: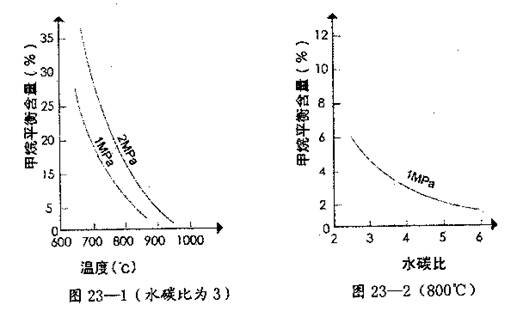
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H0,△S0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
| A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等 |
| B.CO、H2O(g)、CH4、H2的浓度都相等 |
| C.CO、H20(g)、CH4、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
(4)在图23—2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
各物质之间的转换关系如下图,部分生成物省略。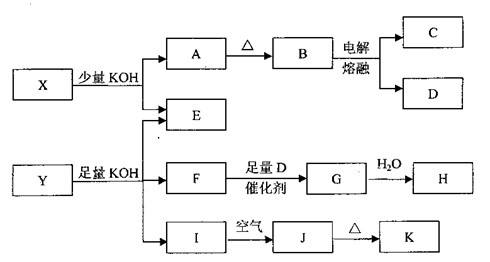
已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊。
请回答下列问题:
(1)写出F的电子式:;
(2)写出化学式:X、Y;
(3)写出C与KOH液反应的化学方程式:;写出H的稀溶液与I反应的离子方程式:;
有X、Y、z、w四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子;W和 Y不属于同一主族。
(1)画出Y原子结构示意图:;
(2)从化合价角度分析,X元素可以排在周期表中I A、VIIA和族;
(3)Z、W两种元素最高价氧化物对应水化合物相互反应的化学方程式:;
(4)已知X2单质的热值为143 kJ·g-1,试写出X2单质在Y2单质中燃烧的热化学方程式:.
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。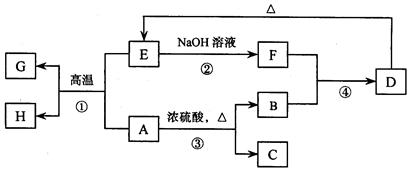
请填空:
(1)H的名称是。
(2)E的两种用途是、。
(3)反应③的化学方程式是。
(4)反应④的离子方程式是。
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。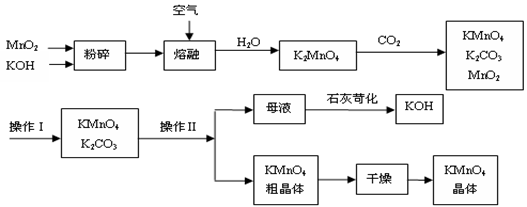
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
⑵上述流程中可以循环使用的物质有、(写化学式)。
⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。