已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×10-36mol2·L-2。 下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
肼(N2H4)——空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+ O2=N2+2H2O。下列关于该电池工作时说法中正确的是
| A.溶液的pH保持不变 |
| B.溶液中的阴离子向正极移动 |
| C.正极的电极反应式:O2+4H++4e—=2H2O |
| D.负极的电极反应式:N2H4+4OH—﹣4e— =4H2O +N2 |
下列各组离子在指定溶液中能大量共存的
| A.无色溶液中:K+、Na+、MnO4—、SO42— |
| B.由水电离出的c (OH— )=1.0× 10-13mol L-1 的溶液中:Na+、Ba2+、Cl—、Br— |
| C.有较多Fe3+的溶液中:Na+、NH4+、HCO3—、SO42— |
| D.强酸性溶液中:K+、NH4+、I—、NO3— |
下列与有机物结构、性质相关的叙述中,正确的是
| A.煤油是石油的分馏产品,可用于保存少量金属钠 |
| B.肥皂可以通过髙分子化合物油脂发生皂化反应制得 |
| C.鸡蛋清中加人CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水 |
| D.淀粉、纤维素完全水解的产物互为同分异构体,且都可与新制氢氧化铜反应 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: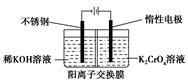
下列说法不正确的是()
| A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动 Cr2O72-+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nk/nCr)为d,则此时铬酸钾的转化率为1-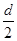 |
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。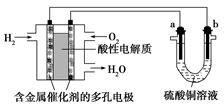
| A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |