“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。若以铜为原料制取硫酸铜或硝酸铜,下列设计你认为符合“绿色化学”思想的反应路线(用化学方程式表示)是
| A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O |
| B.制CuSO4:2Cu + O2= 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O |
| C.制Cu(NO3)2:Cu + 4HNO3(浓)=Cu(NO3)2 +2NO2↑+ 2H2O |
| D.制Cu(NO3)2:3Cu + 8HNO3(稀)=3Cu(NO3)2 +2NO↑+ 4H2O |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。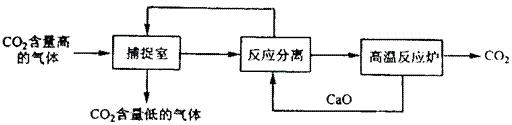
下列有关该方法的叙述中正确的是()
| A.能耗大是该方法的一大缺点 |
| B.整个过程中,只有一种物质可以循环利用 |
| C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是()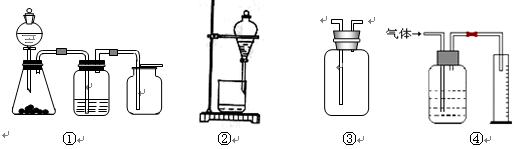
| A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸 |
| B.装置②可用于CCl4萃取碘水中的碘并分液 |
| C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等 |
| D.装置④能用于测量气体体积的装置 |
能正确表示下列反应的离子方程式是()
| A.偏铝酸钠溶液中加入过量盐酸:AlO2- + 4 H += Al3+ + 2 H2O |
| B.向碘化亚铁溶液中通入少量氯气:2Fe2+ + Cl2 = 2Fe3+ + 2 Cl- |
| C.少量CO2通入NaClO 溶液中:CO2+ 2ClO-+H2O=CO32-+2HClO |
| D.铜片跟稀硝酸反应:Cu + NO3- + 4 H+ = Cu2+ + NO↑ + 2 H2O |
下列关于离子能大量共存的是()
| A.Na+、NO3-、S2-、SO32- | B.在c(H+)=10-13mol/L的溶液中K+、Cl-、Al3+、NO3- |
| C.K+、Fe3+、Cl-、S2- | D.K+、Al3+、NO3-、CO32- |
在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中,正确的是
| A.a、b、c、d四个点中,只有b点的化学反应处于平衡状态 |
| B.前10 min内用υ(NO2)表示的化学反应速率为0.04 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是升高温度 |
| D.a点,用υ(NO2)表示的化学反应速率等于用υ(N2O4)表示的化学反应速率 |