已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z的离子结构示意图是 ;
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1。其化学式中含有的化学键有 。
(3)YX3分子的空间构型是 ,Z的氢化物的稳定性比W的氢化物的稳定性_____(填“强”或“弱”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为 。
按要求填空。
(1)经测定某含氧有机物的相对分子质量为94。现取9.4g该含氧有机物充分燃烧后的产物通过浓硫酸后增重5.4g,并收集到标准状况下CO2气体13.44L。则:
①该含氧有机 物的分子式为;
物的分子式为;
②请写出该含氧有机物中官能团的名称。
(2)完成下列变化的化学方程式:
①苯与浓硫酸、浓硝酸的混合酸在50-60℃时的反应。
②苯酚与浓溴水反应。
③二氧化碳通入苯酚钠溶液,产生白色浑浊。
④家用液化气的主要成分之一是丁烷,当1g丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为50kJ。丁烷燃烧的热化学方程式为 。
。
在下列物质中选择相应的序号填空:
①甲烷②乙烯③溴乙烷④甲苯⑤1-丁醇⑥乙酸乙酯⑦苯酚⑧乙二酸
(1)分子结构为正四面体的是;
(2)能与碳酸氢钠溶液反应的是;
(3)能发生水解反应的是;
(4)能与溴水反应并使其褪色但无白色沉淀生成的是 ;
;
(5)能使FeCl3溶液变紫色的是;
(6)能发生消去反应的是。
克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可在一定条件下与氢气反应生成右图所示结构,其反应方程式为(不要求标出反应条件);
反应类型。
(2)化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,所需另一反应物的分子式为
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正 确的是(填字母)
确的是(填字母)
| A. | 化合物Ⅱ可以与 发生酯化反应 |
| B. | 化合物Ⅱ不可以与金属钠生成氢气 |
| C. | 化合物Ⅲ可以使溴的四氯化碳溶液褪色 |
| D. | 化合物Ⅲ不可以使酸性高锰酸钾溶液褪色 |
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为(不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为。
以苯为原料可以通过以下途径制取冬青油和阿司匹林: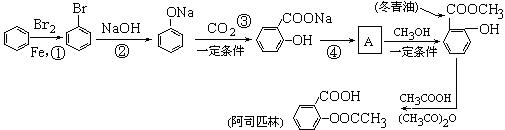
 (1)写出以上转化②的化学反应方程式:
(1)写出以上转化②的化学反应方程式:
________________ ___________________________________________。
___________________________________________。
(2)由A生成冬青油的化学反应方程式:
___________________________________________________________。
(3)A易溶于冬青油中使产品不纯,用NaHCO3溶液反应后,可分液得到叫纯净的冬青油,写出A与NaHCO3溶液反应的化学方程式:
_________________________________________________________________。
(4)1 mol阿司匹林和足量的烧碱共热,有_______mol NaOH被消耗。
(11分)以丙烯为主要原料制取 以及D的流程如下图所示:
以及D的流程如下图所示:
回答下列问题:
(1)C中官能团的名称为__________;D的名称是__________。
(2)由 反应生成A的化学方程式为___________________________________。
反应生成A的化学方程式为___________________________________。
(3)由C生成CH3COCH3的化学方程式为:
_______________________________________________________。
(4)由D生成Cu2O的化学反应方程式为:
________________________________________________________。