下列指定溶液中,各组离子可能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B.在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C.在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D.由水电离的c(H+)=10-13mol·L-1的溶液中:Mg2+、Cl-、K+、SO42- |
用价层电子对互斥理论预测NH2—和BF3的立体结构,两个结论都正确的是 ( )
| A.直线形、三角锥形 | B.V形、三角锥形 |
| C.直线形、平面三角形 | D.V形、平面三角形 |
下列顺序不正确的是()
| A.热稳定性:HF > HCl > HBr > HI |
| B.微粒的半径:Cl-> Na+ > Mg2+ > Al3+ |
| C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 |
| D.分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液 |
已知某元素+2价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置是( )
| A.第3周期第ⅤA族 | B.第3周期第ⅤB族 |
| C.第4周期第ⅦB族 | D.第4周期第ⅤB族 |
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A.最易失去的电子能量最高 |
| B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 |
| D.在离核最近区域内运动的电子能量最低 |
下列表达方式错误的是()
A. |
B.甲烷的电子式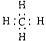 |
| C.硫离子的核外电子排布式 1s22s22p63s23p6 | D.碳-12原子构成  C C |