根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- | C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
对于实验Ⅰ~Ⅳ的描述正确的是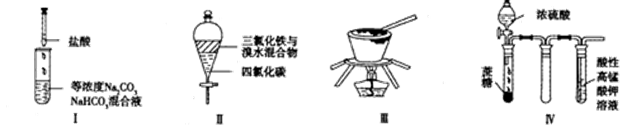
| A.实验Ⅰ:逐滴滴加稀盐酸时,试管中立即产生大量气泡 |
| B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验Ⅲ:从饱和食盐水中提取氯化钠晶体 |
| D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:
则下列叙述错误的是
| A.A气体是NH3,B气体是CO2 |
| B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 |
| C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2∶1 |
| C.若生成0.2 mol HNO3,则转移0.2 mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
在学习中,我们经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是
| A |
向FeCl2溶液中滴入氯水 2Fe2++ Cl2=2Fe3++ 2Cl- |
向FeCl2溶液中滴入碘水 2Fe2++ I2=2Fe3++2I— |
| B |
向澄清石灰水中通入少量CO2气体 Ca2++2OH— +CO2=CaCO3↓+ H2O |
向澄清石灰水中通入少量SO2气体 Ca2++2OH— +SO2=" " CaSO3↓+H2O |
| C |
向Na2CO3溶液中滴入稀HNO3 CO32—+2H+=CO2↑+ H2O |
向Na2SO3溶液中滴入稀HNO3 SO32-+2H+=SO2↑+H2O |
| D |
CO2通入漂白粉溶液中 CO2+ Ca2++2ClO-+H2O=CaCO3↓+ 2HClO |
SO2通入漂白粉溶液中 SO2 +Ca2++2ClO-+H2O=CaSO3↓+2HClO |
硫酸铵在强热条件下分解:4(NH4)2SO4 =" 6" NH3↑+ N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是
| A.BaSO3和BaSO4 | B.BaS | C.BaSO3 | D.BaSO4 |