下列说法正确的是( )
| A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.AgCl的 Ksp = 1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
一定条件下,对于可逆反应X(g)+3Y(g)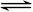 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
A.c1∶c2=1 ∶3 ∶3 |
B.该反应一定是朝正向反应建立平衡 |
| C.X、Y的转化率相等 | D.c1的取值范围为0<c1<0.14 mol/L |
已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5KJ/mol(3) H2(g)+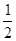 O2(g)=H2O(l) △H3="-285.8KJ/mol"
O2(g)=H2O(l) △H3="-285.8KJ/mol"
试计算下列反应的焓变:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=()
| A.-488.3 KJ/mol | B.+488.3KJ/mol |
| C.-245.7KJ/mol | D.+245.7KJ/mol |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)ΔH<0,下列叙述正确的是()
| A.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C.达到平衡时,反应速率v正(X)=2v逆(Z) |
| D.平衡常数K值越大,X的转化率越大 |
下列实验事实不能证明醋酸是弱酸的是()
| A.常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B.常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中 和 和 |
下列各组变化中,ΔH或Q前者小于后者的一组是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②在稀溶液中:含0.5 mol H2SO4硫酸与含1 mol NaOH的溶液混合:H+(aq)+OH-(aq)=H2OΔH1
NaOH(aq)+CH3COOH(aq) =CH3COONa(aq)+H2O(l)ΔH2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3 (s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
| A.①②③ | B.②③ | C.①② | D.①③④ |