硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
(1)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为 。
(2)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。
已知:25℃时,H2SO3  HSO3 -+H+ K=1.5×10-2
HSO3 -+H+ K=1.5×10-2
H2CO3 HCO3 -+H+ K=4.4×10-7
HCO3 -+H+ K=4.4×10-7
下列试剂中适合用作该法吸收剂的是 (填字母序号)。
a.石灰乳 b. Na2SO3溶液 c. Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100 mL 0.2 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是 (填字母序号)。
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
(3)某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下: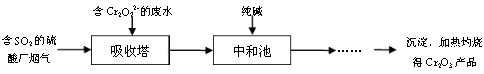
①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为 。
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为 。
在下列事实中,什么因素影响了化学反应速率:
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:__________________。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_____________________。
(3)同浓度、同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有快有慢:
___________________________________。
(4)夏天的食品易变质,而冬天不易发生该现象:________________________。
实验室常用二氧化锰与浓盐酸反应来制取氯气。
MnO2+4HCl(浓)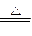
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
现用200克36.5%的浓盐酸(过量)与17.4克二氧化锰反应, 试回答下列问题:
(1)理论上可制得标准状况下的氯气的体积为L
(2)将反应后剩余的溶液用水稀释至500mL,则稀释后溶液HCl的物质的量浓度是
将100mL 0.2mol/L 的盐酸与100mL 0.3 mol/L 的盐酸混合(假设混合时体积变化忽略不计),求
(1)混合后盐酸溶液的物质的量浓度为
(2)若欲将该200mL盐酸溶液浓度重新恢复为0.3mol/L,则需要向其中通入标况下的HCl气体L(体积变化忽略不计)
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32-、 SO42-、 和 Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,
③_______________,④_______________,⑤冷却结晶。
(2)用托盘天平称量样品时,若某同学把样品放在右盘,砝码放在左盘,当天平平衡时读数为24.4g(一克以下用游码) ,则样品的实际质量为_______________
(3)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有_______________ 生成,证明溶液中有碳酸根离子。
②在第二支试管里加入足量_____________ 后,再加入_______________ ,可观察到有白色沉淀生成,证明溶液中有硫酸根离子。(写物质名称)
③在第三支试管里加适量的硝酸银,观察到有沉淀产生,由此证明溶液中一定含Cl-。你认为该结论是否严密化?为什么?_______________________ 。
某同学用胆矾晶体(CuSO4·5H2O )配制0.40mol/L的CuSO4溶液1000mL,
回答下列问题:
(1)所需仪器为:(1000mL)容量瓶、托盘天平、药匙、 胶头滴管 ,还需要哪些玻璃仪器才能完成该实验,请写出:①___________ ,②___________
(2)写出该实验步骤 ①计算 ②称量胆矾__________g ③ ___________ ④转移 ⑤洗涤并转移 ⑥定容 ⑦摇匀
(3)下列情况对所配制的CuSO4溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.容量瓶用蒸馏洗涤后残留有少量的水________________
B.所用过的烧杯、玻璃棒未洗涤________________
C.定容时俯视刻度线________________