海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为 。
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V="67.2" L时,溶液中离子浓度大小关系为 。
[选修物质结构].铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂。
(1)合成氨工业使用的催化剂是以铁为主体的多成分催化剂。
①NH3中N原子的杂化轨道类型是。
②N与O同属第二周期,N的第一电离能比O大的原因是。
③根据等电子体原理,写出一种NH4+是等电子体的微粒的化学式____________。
(2)二茂铁[(C5H5)2Fe]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如右所示,其中氢原子的化学环境完全相同。
①Fe的基态电子排布式为____________。
②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是 _______________。
③1mol环戊二烯( )中含有σ键的数目为_________个。
)中含有σ键的数目为_________个。
(3)普鲁士蓝俗称铁蓝,结构如图所示,K+未画出),每隔一个立方体在立方体中心含有一个K+离子,普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:_____________。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H=mkJ·mol-1
2SO3(g);△H=mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m0(填“>”“=”或“<”);
b点时v(正)v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将(填“增大”、“减小”或“不变”)。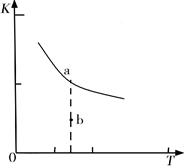
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。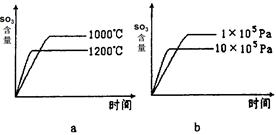

(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O NH3·H2O+H+,则该反应常温下的平衡常数K=(已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K=(已知:常温下,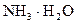 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
固体样品X由Cu、SiO2、KNO3、NH4Cl中的一种或几种混合而成。某同学取该样品进行如下操作(部分产物已略去)
试回答:
(1)仅由步骤I中的实验现象,可得X中一定含有。
(2)步骤Ⅱ中固体减少的化学业反应方程式为。
(3)为进一步确定上述混合物X的组成,该同学另取 20.0g固体X加蒸馏水溶解、测得滤液的pH<7,他判断一定有NH4Cl用离子方程式表示其原因。
(4)将(3)中加蒸馏水溶解后的混合后体系再经过过滤、(填操作名称)、称量,得到剩余固体的质量为9.80g,则20.0gX中NH4Cl的质量为。
有一种广泛应用于汽车、家电产品上的高分子涂料,是按下列流程生产的,图中的M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
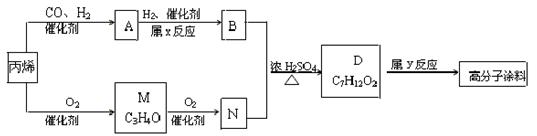
试写出:
(1)物质的结构简式:A,M;物质A的同类别的同分异构体为。 (2)N+B D的化学方程式。
(2)N+B D的化学方程式。
(3)反应类型:x,y:。
丙二醇和其他无机原料合成环状化合物D。
(1)请在下列方框内填入合适的化合物的结构简式:
(2)C和水发生加成反应生成B的化学方程式;
(3)D和NaOH水溶液共热的化学方程式;
(4)C属于______类化合物,名称为______。