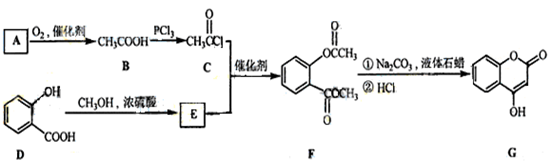
I.施安卡因(G)是一种抗心律失常药物,可由下列路线合成。
(1)已知A是 的单体,则A中所含官能团的名称是______ 。
的单体,则A中所含官能团的名称是______ 。
(2)B的结构简式为______;用系统命名法给C命各为______。
(3)C与足量NaOH醇溶液共热时反应的化学方程式为______。F→G的反应类型为______。
(4)L是E的同分异构体,分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有 、_______、_______、_______。
、_______、_______、_______。
Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰。按如下路线,由H可合成高聚物V
(5)H的结构简式为______。
(6)Q→V反应的化学方程式______.
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
| t(℃) |
750 |
850 |
1000 |
| CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。

 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的结构简式为____________,1molG最多能与______molH2在催化剂作用下发生加成反应。
(2)检验C中含有Cl元素时,可选取的试剂是_________(填编号,按选取先后顺序排列)
a.氢氧化钠的水溶液 b.稀盐酸 c.硝酸银 d.稀硝酸
(3)写出F和过量NaOH溶液共热时反应的化学方程式______________________。
(4)H是E的同分异构体,H中苯环上有只有两个取代基,且位于苯环的对位,H可以使氯化铁溶液显紫色,可以和碳酸氢钠溶液反应放出气体,则H的结构简式为。
C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。
(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。
(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1)吸收塔内发生反应的化学方程式为_____________________(配平化学方程式)。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为________克。
(2)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为____________;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是_______;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时的S2-的浓度为____。
已知

运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
① CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ/mol
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ/mol
② CO(g)+ O2(g)=CO2(g)△H=-283.0kJ/mol
O2(g)=CO2(g)△H=-283.0kJ/mol
③ H2(g)+ O2(g)=H2O(l)△H=-285.8kJ/mol
O2(g)=H2O(l)△H=-285.8kJ/mol
则CO(g)+2H2(g)=CH3OH(g)△H=__________kJ/mol
(2)下列措施中能够增大上述合成甲醇反应的速率的是_________(填写序号)。
a.使用高效催化剂
b.降低反应温度
c.增大体系压强
d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示 。
。
①P1_________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=_________(mol L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”、或“不变”)
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式__________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如右图所示。请写出开始时阳极反应的电极反应式____________。