下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②常温常压下,16 g O3所含的原子数为NA
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑤碳酸氢根离子的电离方程式可表示为:
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3 (g) △H=-38.6kJ·mol-1
2NH3 (g) △H=-38.6kJ·mol-1
| A.全部 | B.②⑤ | C.②③④⑦ | D.②④⑦ |
下列叙述错误的是
| A.氯水保存在棕色试剂瓶中 | B.Na2O2可用于呼吸面具中作为氧气的来源 |
| C.SiO2用于制造太阳能电池 | D.Fe2O3常用于制造红色油漆和涂料 |
工业上冶炼金属镁通常采用的方法是
| A.热分解法 | B.热还原法 | C.电解法 | D.结晶法 |
下列关于二氧化硫的判断错误的是
| A.无色无气味 | B.有毒 | C.能使品红褪色 | D.非金属氧化物 |
下列化学用语书写正确的是
| A.乙烯的结构简式 CH2CH2 |
B.氯离子的结构示意图: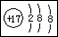 |
| C.双氧水的分子式 HO |
| D.碳酸钾的电离方程式 K2SO4 = K2++SO42- |
将20mL0.5mol/LAl2(SO4)3溶液加水稀释到500mL,稀释后溶液中SO42-浓度为
| A.0.01mol/L | B.0.02mol/L | C.0.03mol/L | D.0.06mol/L |