已知反应2A B+3C,在200C进行时其v(A)="5" mol·L-1·s-1。如果温度每升高100C,此反应速率增大到原来的2倍。则当其他条件不变时,温度升至500C时,此反应的化学反应速率v(C)是
B+3C,在200C进行时其v(A)="5" mol·L-1·s-1。如果温度每升高100C,此反应速率增大到原来的2倍。则当其他条件不变时,温度升至500C时,此反应的化学反应速率v(C)是
A.20 mol·L-1·s-1 B.40 mol·L-1·s-1
C.60 mol·L-1·s-1 D.150mol·L-1·s-1
在一定温度不同压强(P1<P2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
下列变化过程中,ΔS<0的是
| A.氯化钠溶于水中 | B.NH3(g)和HCl(g)反应生成NH4Cl |
| C.干冰的升华 | D.CaCO3(S)分解为CaO(S)和CO2(g) |
在2升的密闭容器中,发生以下反应:2A (气)+B(气)
(气)+B(气) 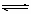 2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
下列说法正确的是
从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: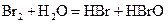 ,当加入NaOH溶液后颜色变浅 ,当加入NaOH溶液后颜色变浅 |
B.对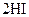   平衡体系增加压强使颜色变深 平衡体系增加压强使颜色变深 |
C.反应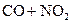  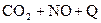 升高温度使平衡向逆方向移动 升高温度使平衡向逆方向移动 |
D.合成氨反应: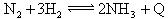 ,为使氨的产率提高,理论上应采取低温高压的措施 ,为使氨的产率提高,理论上应采取低温高压的措施 |