下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中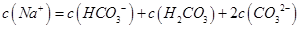 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: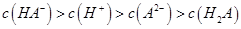 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液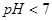 |
某溶液中可能含有I-、Cl-、SO32-、SO42-。向该溶液中加入一定量溴水,充分振荡后溶液呈无色。由此可知原溶液( )
| A.肯定含有SO32- | B.肯定不含I- | C.肯定不含Cl- | D.肯定含有SO42- |
能够用于鉴别二氧化碳和二氧化硫的溶液是( )
| A.澄清石灰水 | B.品红溶液 | C.酸性高锰酸钾溶液 | D.BaCl2溶液 |
硝酸与一定量的铁充分反应,则溶液中( )
| A.一定会有Fe2+ | B.可能含Fe2+ | C.一定含Fe3+ | D.可能含Fe3+ |
有NaCl、FeCl2、FeCl3、AlCl3、MgCl2五种溶液,只需一种试剂就可把它们鉴别开来,这种试剂是( )
| A.盐酸 | B.烧碱溶液 | C.氨水 | D.KSCN溶液 |
下列溶液通入过量CO2后,最终溶液中有沉淀析出的是( )
| A.Na2SO3 | B.BaCl2 | C.Ca(ClO)2 | D.Na[Al(OH)4] |