配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
| A.使用滤纸称量氢氧化钠固体 |
| B.容量瓶中原来存有少量蒸馏水 |
| C.溶解NaOH的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1 NaOH溶液过程示意图中有错误的是(填序号)______。
甲、乙两人分别用不同的方法配制100ml 3.0mol/L的H2SO4溶液。
(1)甲:量取25.0 ml 12 mol/L浓H2SO4倒入加入约25mL 蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。 实验所用的玻璃仪器除烧杯和胶头滴管外,还有的玻璃仪器有,,;
蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。 实验所用的玻璃仪器除烧杯和胶头滴管外,还有的玻璃仪器有,,;
(2)乙:用100 ml 量筒量取25.0 ml 12 mol/L浓H2SO4,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
你认为此法是否正确?。若不正确,指出其中错误 之处,。
之处,。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应 的还原剂是,氧化剂是。
的还原剂是,氧化剂是。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,方法是。这一操作的目的是
,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,方法是。这一操作的目的是 。
。
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: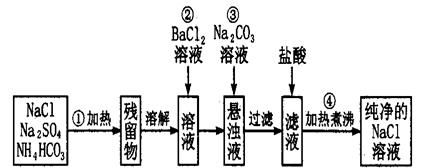
如果此方案正确,那么:
(1)操作②是否可改为加硝酸钡溶液?为什么?
,。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______
__;
(3)操作③的目的是_;
(4)操作④的目的是_______________________________。
欲用98 %的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
%的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
A.用量筒量取浓硫酸
B.反复上下颠倒摇匀
C.加蒸馏水至刻度线下1~2cm时改用胶头滴管加水至刻度线
D.洗净所用仪器
E.稀释浓硫酸
F.将稀释后并冷却的硫酸溶液注入容量瓶
G.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也注入容量瓶
(1)其操作正确的顺序为(填编号):。
① D A E F G B C② D A E F G C B③ D A F E G B C
(2)简要回答下列问题:
①所需浓硫酸的体积为mL(小数点后保留一位)。现有10mL 、15mL、20mL、50mL四种量筒,应选用mL的量筒最好。
②洗涤烧杯2~3次,洗涤液也要转入容量瓶,否则会使结果浓度。(填偏高,偏低或无影响)
③稀释后并冷却的硫酸用注入中。
④加蒸馏水定容时必须使溶液凹液面与容量瓶刻度线相切,如果不小心将水加过刻度线应 。
。
(3)下列实验操作,造成溶液浓度偏低的是。
A.容量瓶用蒸馏水洗净后未经干燥处理
B.转移过程中有少量溶液溅出
C.稀释后的硫酸没有冷却到室温就转移到容量瓶中并加水定容
D.定容时,俯视容量瓶的刻度线
E.摇匀后发现液面低于刻度线,再用胶头滴管加水至刻度线
I.下图是某学生设计的制取和收集某些气体的实验装置(可加热)。
(1)该装置在加入反应物前,应首先进行的实验操作是。
(2)下列气体的制取中,若用排空气法收集,可使用该装置制备和收集的是(选填编号,下同)__________若用排水法收集(集气瓶中充满水),可使用该装置制备和收集的是 ___________。
①用Zn与稀盐酸反应制H2
②用CaCO3与稀盐酸反应制CO2
③用固体NaOH和浓氨水制NH3
④用Cu与稀HNO3反应制NO
⑤用MnO2与双氧水反应制O2
⑥浓硫酸与铜片反应制SO2
⑦用MnO2与浓盐酸反应制Cl2
II. 某校化学研究性学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取一定量的浓硫酸与足量Zn充分反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑浊消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又 会明显增加。
会明显增加。
试回答:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接、接b,c接、接d;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,该实验中起到同样作用的装置是____________;
(3)能证明浓硫酸具有强氧化性的实验现象为;
(4)反应较长时间后气泡量又会明显增加的原因是;
(5)D中浑浊消失的离子方程式为。