对下列过程中发生反应的叙述正确的是
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程所涉及的反应均为置换反应 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g) 2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是()
2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是()
| A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 |
| B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 |
| C.2 s时物质A的转化率为70% |
| D.2 s时物质B的浓度为0.7 mol · L-1 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
A.CO与HbO2反应的平衡常数K=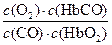 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+ O2(g)="CO(g)" △H=" -393.5" kJ/mol O2(g)="CO(g)" △H=" -393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)△H="+571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" -890.3" kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=" -1" 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=" -1" 400 kJ/mol |
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)  Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
| A.n(Ca2+)减小 | B.c(Ca2+)不变 | C.n(OH-)增大 | D.c(OH-)减小 |
下列离子方程式书写正确的是
| A.次氯酸钙溶液中通入过量的二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| B.硫酸亚铁溶液中加入过氧化氢溶液: Fe2++2H2O2+4H+= Fe3+ + 4H2O |
| C.用氨水与少量的二氧化硫反应: NH3·H2O+SO2 = NH4++HSO3‑ |
| D.硝酸铁溶液中加过量氨水: |
Fe3+ +3 NH3·H2O =" Fe" (OH)3↓+3NH4+