某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为: _ ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。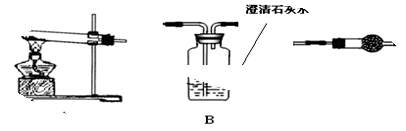
(1)各装置连接顺序为 
 。
。
(2)装置C中装有的试剂名称是 。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。
(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以
,
和金属离子的配离子
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和
,在
<2的条件下加热蒸馏,蒸出所有的
,并用
溶液吸收。
②滴定:将吸收液调节至
>11,以试银灵作指示剂,用
标准溶液滴定
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
(1)水样预处理的目的是。
(2)水样预处理的装置如右图,细导管插入吸收液中是为了。
(3)蒸馏瓶比吸收液面要高出很多,其目的是。
(4)如果用盐酸代替磷酸进行预处理,实验结果将(填"偏高"、"无影响"或"偏低")。
(5)准确移取某工厂污水100
,经处理后用浓度为0.01000
的硝酸银标准溶液滴定,终点时消耗了21.00
。此水样中含氰化合物的含量为
(以
计,计算结果保留一位小数)。
为测定一种气态烃A的分子式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO、水蒸气。学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除),试完成下列问题: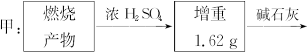
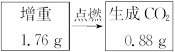
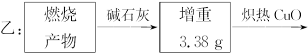

(1)两种方案能否都可求出A的实验式(即C、H原子个数比)?
(2)若能求,通过计算求出A的实验式。
(3)若要确定A的分子式,是否还需要测定其他数据?如果需要,该测定哪些数据?
如下图,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体点燃,把燃烧后生成的气体通过A、B两个洗气瓶。试完成下列问题: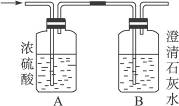
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是___________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是___________。
(3)若A和B两个洗气瓶的质量都增加,则气体X可能是______________________。
下图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷盘内的烃样品经加热分解或气化后用纯O2气流驱赶经过灼热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。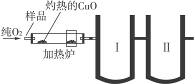
已知下列数据:
| 瓷盘 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
| 瓷舟 |
样品+瓷舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
| A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
(1)烃样品在反应过程中所用的氧化剂是________________________。
(2)吸收管Ⅰ应装的吸收剂是________,吸收管Ⅱ应装的吸收剂是________。
(3)样品中碳的质量分数的数学表达式是____________________。
(4)样品中氢的质量分数的数学表达式是____________________。
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: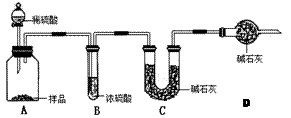
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,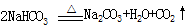 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用(填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是。
乙:准确称取10.00g样品后,用(填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 |
实验结果的评价 |
实验失败的主要原因及对结果的影响 |
| 甲 |
失败 |
||
| 乙 |
 成功 成功 |
||
| 丙 |
 成功 成功 |