下列实验操作或实验结论正确的是
A.实验室用如图所示装置制取少量氨气 |
| B.实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 |
| C.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 |
| D.醋酸钠结晶水合物与碱石灰共热制取甲烷 |
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X+既无电子也无中子,Z原子的最外层电子数与最内层相等,Y、Z的最高正价之和与Q的最高正价相等,W的最高正价与最低负价代数和为0。X的单质与Q的单质混合强光照时可发生爆炸。下列说法正确的是
| A.直接电解海水可获得Z的单质 | B.原子半径:Q>W>Z>Y>X |
| C.Q的含氧酸一定是强酸 | D.Q的一种氧化物可作为自来水的杀菌消毒剂 |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
| A.溶液的质量变化:甲减小,乙增大 |
| B.溶液pH变化:甲减小,乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+ |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中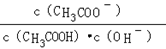 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
下列实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| B |
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 |
证明Na2CO3溶液中存在水解平衡 |
| C |
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 |
证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D |
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
证明非金属性S>C |
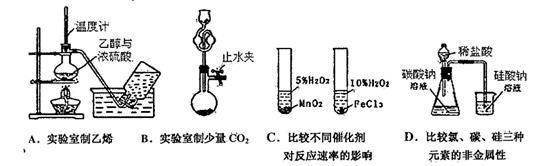
下列装置合理,且能达到实验目的的是