粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: 、
、 、
、 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| |
 |
 |
 |
| 开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
| 完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
| |
第一次实验 |
第二次实验 |
| 坩埚质量(g) |
14.520 |
14.670 |
坩埚质量 晶体质量(g) 晶体质量(g) |
17.020 |
18.350 |
| 第一次加热、冷却、称量(g) |
16.070 |
16.989 |
| 第二次加热、冷却、称量(g) |
16.070 |
16.988 |
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2 Na2S2O5。
Na2S2O5。
(1)a仪器的名称为:,实验前要进行。
装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)浓硫酸(填“能”或“不能”)用稀硫酸代替,原因是。
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(4)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”、“偏低”或“不变”)。
“摩尔盐”[(NH4)2Fe(SO4)2·6H2O是分析化学中的重要试剂。查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂。某学习小组欲探究其分解产物。
I.【提出猜想】摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
经认真分析,通过推理即可确定,猜想____不成立(填序号)。
II.【实验探究】为检验分解产物,甲同学设计了如下实验装置。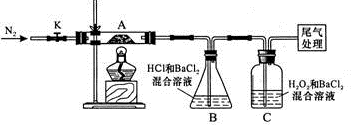
请回答下列问题:
(1)B装置的容器名称是。
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是。
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为。
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是。
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中,。
III.【实验反思】
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是____。
化学是一门以实验为基础的学科,试回答以下问题。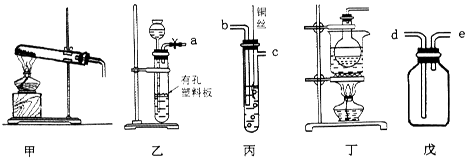
(1)实验室中制取并收集少量氨气,可选用上述_____(填装置序号)装置,氨气应从收集装置的_____(填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,正确的连接顺序为___________________(用接口字母表示),装置乙的作用是____________,丙中产生NO的离子方程式为______________________。
(3)二氧化氯(C1O2)是一种常用高效消毒剂,某研究小组利用丁装置制备C1O2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和K2SO4,则该反应中氧化产物与还原产物物质的量之比为_________。
②温度过高时,二氧化氯的水溶液有可能发生爆炸。在反应开始前将烧杯中的水加热到80%,然后停止加热,并使其保持在60℃~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是____________。
③将二氧化氯溶液加入到硫化氢溶液中,然后加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式________________。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: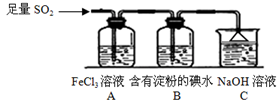
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是 。
(本题共12分)磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4,一种生产流程如下: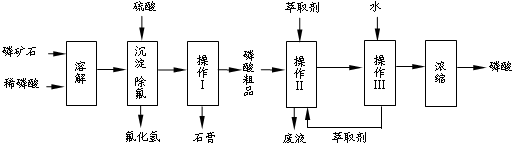
已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF
38、写出有关操作的名称:Ⅰ___________、Ⅲ。工艺流程中设计操作Ⅱ与Ⅲ的目的是。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。该产品中磷酸的质量分数为(保留3位小数)。