在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2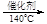 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3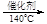 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
取5.64gCu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液。请通过计算确定:(写出计算过程)
(1)所得溶液的物质的量浓度;
(2)残留固体的成分和质量分别是多少克?
将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
(1)Fe2O3的质量为g ;
(2)稀H2SO4物质的量浓度为。
标准状况下CO与CO2混合气体的平均相对分子质量为32。将该气体完全通入盛有足量Na2O2的容积为2.24升的密闭容器中(忽略固体物质的体积),引燃,完全反应后,容器内固体生成物的质量为__________g。
一定温度下,将60mLCO、CO2与O2的混合气体用电火花引燃,完全反应后冷却到原来温度,体积减少了10mL。将反应后的气体通过足量的NaOH(aq),体积又减少了30mL。剩余气体可使带余烬的木条复燃。原混合气中CO的体积为________mL,CO2的体积为________mL。
某银币(铜、银合金)质量为25g,为测定其元素的质量分数,向其中加入75 mL 12 mol·L-1的浓硝酸使其完全溶解。实验结束后,A中烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75 mL。
①计算参加反应的硝酸的物质的量是_______ mol。
②写出你设计的测定该银币中银的质量分数的最简单的实验方案(操作步骤及计算式)__________