一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
下列说法不正确的是
A.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e→2H2O
D.在pH<4溶液中,碳钢主要发生析氢腐蚀
咖啡鞣酸具有较广泛的抗菌作用,结构简式如图所示:下列关于咖啡鞣酸的说法,不正确的是
|
| A.分子式为C16H18O9 |
B.在一定条件下能发生消去反应 |
| C.1 mol咖啡鞣酸水解时可消耗8 mol NaOH | |
| D.与浓溴水既能发生取代反应又能发生加成反应 |
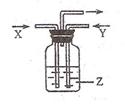
下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如右下图所示),一定没有沉淀生成的是
| X |
Y |
Z |
|
| A |
NO2 |
SO2 |
BaCl2 |
| B |
NH3 |
O2 |
Al2(SO4)3 |
| C |
NH3 |
CO2 |
NaCl(饱和) |
| D |
CO |
O2 |
Ca(OH)2 |
下列说法正确的是
| A.在周期表中金属与非金属的分界处可以找到半导体材料 |
| B.H2S、H2Se、HF的热稳定性依次增强 |
| C.NaOH、KOH、Mg(OH)2的碱性依次减弱 |
| D.Cl、S、N元素的非金属性依次增强 |
下列说法不正确的是
| A.根据沸点差异可以判断两种液体混合物是否可用蒸馏方法进行分离 |
| B.根据固体溶解度曲线可以判断物质结晶的方法 |
| C.根据熵变可以判断所有化学反应能否自发进行 |
| D.根据化学平衡常数可以判断化学反应进行的限度 |
下列说法正确的是
| A.淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体
|
B.CH2=CHC(CH3)3与氢气完全加成后,生成物的名称是3,3-二甲基丁烷 |
C.CS2的结构式为S=C=S |
| D.一CH3(甲基)的电子式为 |