25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L NaHSO4 | B.0.1 mol/L Na2CO3溶液 |
| C.pH = 4盐酸溶液 | D.pH =11氨水 |
下列有关物质的性质与应用不相对应的是()
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 |
下列变化一定属于化学变化的是()
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色⑧分馏⑨ NO2气体冷却后颜色变浅⑩潮解
| A.①②③④⑦ | B.③④⑤⑦ | C.①③④⑦⑩ | D.①③⑤⑦⑨ |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
用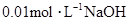 溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是( )
| A.盐酸 | B.硫酸 | C.高氯酸 | D.醋酸 |
某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复原来的温度.下列叙述正确的是( )
| A.沉淀物的质量为5.6g |
| B.沉淀物的质量为7.4g |
| C.饱和石灰水的质量大于98.2g |
| D.饱和石灰水的质量小于98.2g |