某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ. 解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需 (填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有 (填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:① ;② 。
Ⅱ. 解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: ,
(2)从实验Ⅱ可得出的结论是 。
Ⅲ. 解决问题3
设计如下装置(夹持装置未画出):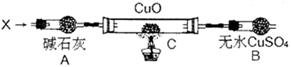
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到0.28 g单质气体Y。
(1)X气体的摩尔质量是 。
(2)C中发生反应的化学方程式为 。
(12分) 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。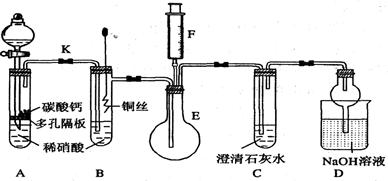
请回答有关问题:
(1)设计装置A的目的是;为达到此目的,应进行的操是。
(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是;B中反应的离子方程式为:。
(3)装置E和F的作用是;为实现此作用,其操作方法是。
(4)装置D的作用是。
实验室用图示装置制取乙酸乙酯。
(1)浓H2SO4的作用是:①_____ _ __,②_____________。
(2)右边收集试管内装有,导气管不能插入液面以下,原因是。加热前,大试管中加入几粒碎瓷片的作用是______________。
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
试回答下列问题。
(1)该实验中漏斗的作用是什么?。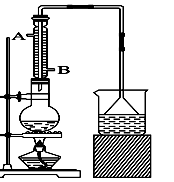
(2)反应装置中的烧瓶应选择下列哪种规格最合适()
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是()
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是用洗涤后分液。
A、浓NaOH溶液 B、Na2SO3溶液 C、CCl4 D、水
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:
。
(每空2分,共18分)
(一)实验室用下图装置制取少量溴苯,试填写下列空白。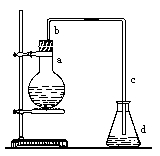
(1)在烧瓶a中装的试剂是。
(2)长直导管b的作用:。
(3)请你分析导管c的下口可否浸没于液面中?(填“可”或 “否”)。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液,有关反应的离子方程式:。
(二)某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
乙醇的催化氧化反应是________反应(填“放热”或“吸热”),
该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是
(填戊装置中导管代号):乙接、_______接丙;
若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。
下图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): _____________ , ___________
(2)试管C中苯的作用是_____ 。反应开始后,观察D和E两试管,看到的现象为_____ 。
(3)在上述整套装置中,具有防倒吸作用的仪器有_____ (填字母)。