实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。
试回答下列问题。
(1)该实验中漏斗的作用是什么? 。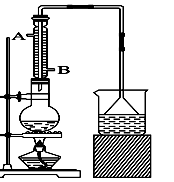
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是用 洗涤后分液。
A、浓NaOH溶液 B、Na2SO3溶液 C、CCl4 D、水
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:
。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3-______MnO2(填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________。
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是 。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是____________(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O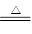 CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
(1)A装置为加热分解草酸的装置,该装置错误是_____________,C装置中盛放的试剂是_______(填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯。这4步操作由先到后的顺序为________(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 |
0.01mol/L KMnO4 |
0.1mol/L H2C2O4 |
0.1mol/L H2SO4 |
MnSO4固体 |
| 甲 |
4 mL |
x mL |
1 mL |
无 |
| 乙 |
y mL |
2mL |
1 mL |
有 |
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是_____________。
与
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器
的名称是。安装
中导管时,应选用图2中的。
(2)打开
的活塞,A中发生反应:
+
=
↑+
↑+
+
。
为使
在
中被稳定剂充分吸收,滴加稀盐酸的速度宜(填"快"或"慢")。
(3)关闭
的活塞,
在
中被稳定剂完全吸收生成
,此时
中溶液的颜色不变,则装置
的作用是。
(4)已知在酸性条件下NaClO2可发生反应生成
并释放出
,该反应的离子方程式为,在
释放实验中,打开
的活塞,
中发生反应,则装置
的作用是。
(5)已吸收
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是,原因是。
(15分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL |
15.00 |
19.00 |
19.80 |
19.98 |
20.00 |
20.02 |
21.00 |
23.00 |
25.00 |
| E/mV |
-225 |
-200 |
-150 |
-100 |
50.0 |
175 |
275 |
300 |
325 |
实验(二)碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一)中的仪器名称:仪器A ,仪器B 。
(2)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二)中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为
和
,还有少量
、
、
、
和
等)为原料制备硼酸(
)的工艺流程如图所示:
回答下列问题:
(1)写出
与硫酸反应的化学方程式。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有(写出两条)。
(2)利用的磁性,可将其从"浸渣"中分离。"浸渣"中还剩余的物质是(写化学式)。
(3)"净化除杂"需先加
溶液,作用是。然后再调节溶液的
约为5,目的是。
(4)"粗硼酸"中的主要杂质是填名称)。
(5)以硼酸为原料可制得硼氢化钠(
),它是有机合成中的重要还原剂,其电子式为。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程。