CoCl2•6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 、 。
(4)“操作1”中包含的基本实验操作,它们依次是 和过滤、减压烘干。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。.

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。请回答下列问题。
(1)A中的方程式为(用单线桥标电子转移方向与数目);
(2)试管B中饱和食盐水的作用;
(3)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(4)试管D中充满10% NaOH溶液,NaOH溶液的作用是;
(5)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为,试管D中的气体检验方法为____________;
(6)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有:(用方程式回答)。对于质疑可以采用对比实验来解决。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。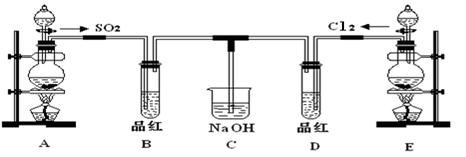
(1)实验室用装置A制备SO2。从物质类别看,SO2属于______(填“酸性”、“两性”或“碱性”)氧化物;
(2)实验室用装置E制备Cl2,写出该反应的离子方程式:_________________________。反应中的液体反应物在反应中所表现出的性质为:_______;
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:_____________________,D:_________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)____________________________。
(5)有人预测SO2能使酸性高锰酸钾溶液褪色,你认为该预测是否合理?(填“合理”或“不合理”),理由是。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。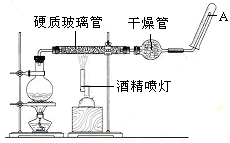
(1)写出该反应的化学方程式,其中氧化剂是,还原剂是。8.4g铁粉参加反应,转移电子mol。
(2)玻璃管中石棉绒的作用是,实验开始时应先点燃,实验结束时应先熄灭。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶里应事先放置,其作用是。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是,若溶液未变红色则说明硬质试管中固体物质的成分是。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)。
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式,。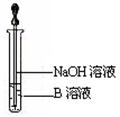
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是,并且配制含Fe2+的盐溶液时应加入少量。
Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 |
| B.升华 |
| C.结晶 |
| D.分液 |
E.蒸馏
F.层析
G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
Ⅱ.海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①所需仪器除酒精灯、三脚架、泥三角外,还需要。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是。
(3)步骤④反应的离子方程式是。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是________________________。
(5)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:。
利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:
(1)SO2与过量NaOH溶液反应的离子方程式为。
(2)滤渣的主要成分为(填化学式)。
(3)反应1中加双氧水的目的是。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)