在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。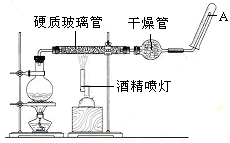
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是 (用离子方程式表示)。
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 , 。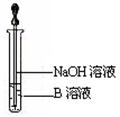
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
某科研小组用
和浓盐酸制备
时,利用刚吸收过少量
的
溶液对其发扬进行吸收处理。
(1)请完成
与过量
溶液反应的化学方程式:
+2
=。
(2)反应
中的还原剂为。
(3)吸收尾气一段时间后,吸收液(强碱性)肯定存在
和
。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的
的影响)
①提出合理假设
假设1:只存在

假设2:既不存在 也不存在
假设3:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3
、1
、0.01
、淀粉-
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3
至溶液呈酸性,然后将所得溶液分置于
试管中 |
 |
| 步骤2: |
|
| 步骤3: |
高纯
是制备高性能磁性材料的主要原料。实验室以
为原料制备少量高纯
的操作步骤如下:
(1)制备
溶液:
在烧瓶中(装置见上图)加入一定量
和水,搅拌,通入
和
混合气体,反应3
。停止通入
,继续反应片刻,过滤(已知
)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使
尽可能转化完全,在通入
和
比例一定、不改变固液投料的条件下,可采取的合理措施有、。
③若实验中将
换成空气,测得反应液中
、
的浓度随反应时间t变化如下图。导致溶液中
、
浓度变化产生明显差异的原因是。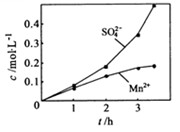
(2)制备高纯
固体:已知
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
开始沉淀时
。请补充由(1)制得的
溶液制备高纯
的操作步骤[实验中可选用的试剂:
、
、
、
]。
①;②;③;④;⑤低于100℃干燥。
高纯 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以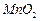 为原料制备少量高纯
为原料制备少量高纯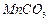 的操作步骤如下:
的操作步骤如下:
(1)制备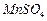 溶液:
溶液: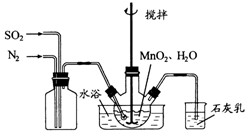
在烧瓶中(装置见上图)加入一定量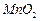 和水,搅拌,通入
和水,搅拌,通入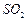 和
和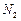 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入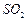 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知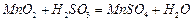 )。
)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使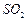 尽可能转化完全,在通入
尽可能转化完全,在通入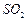 和
和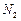 比例一定、不改变固液投料的条件下,可采取的合理措施有、。
比例一定、不改变固液投料的条件下,可采取的合理措施有、。
③若实验中将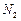 换成空气,测得反应液中
换成空气,测得反应液中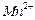 、
、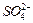 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中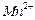 、
、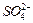 浓度变化产生明显差异的原因是。
浓度变化产生明显差异的原因是。
(2)制备高纯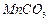 固体:已知
固体:已知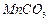 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;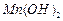 开始沉淀时
开始沉淀时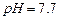 。请补充由(1)制得的
。请补充由(1)制得的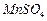 溶液制备高纯
溶液制备高纯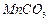 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: 、
、 、
、 、
、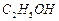 ]。
]。
①;②;③;④;⑤低于100℃干燥。
某研究性学习小组在网上收集到如下信息:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a. 边振荡盛有2%的
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2
乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的
增大
【提出假设】
假设1:
具有氧化性,能氧化
。
假设2:
溶液显酸性,在此酸性条件下
能氧化
。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出
,验证了假设1的成立。请写出
氧化
的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:
溶液中的
和
都氧化了
。你是否同意丙同学的结论,并简述理由:。
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(
、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
(1)第②步反应得到的沉淀
的化学式为。
(2)第③步反应的离子方程式是。
(3)第④步反应后,过滤
所需的玻璃仪器有。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:、。
(4)若废旧锂离子电池正极材料含
的质量为18.1g,第③步反应中加入20.0
3.0
的
溶液,假定正极材料中的锂经反应③和④完全转化为
,则至少有
参加了反应。