维生素C也称为抗坏血酸,是一种无色晶体,其水溶液显酸性,其化学特性是易失去电子,在水溶液中或受热时易被氧化。
[实验探究]
| 实验内容 |
实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊溶液 |
溶液变为 色 |
| 将维生素C的溶液逐渐加入到2mL溶有淀粉的碘水中 |
溶液由蓝色变为无色 |
[问题思考]
①生的新鲜蔬菜比炊熟的蔬菜所含维生素C (填“高”或“低”)。
②维生素C可使食物中的Fe3+转化为Fe2+,这一过程体现了维生素C的 (填“氧化性”或“还原性”)。
③医生建议坏血病患者应多吃的食物是 (任举一种)。
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓) Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的()
A.实验室制氧气的装置B.实验室制氢气的装置
C.实验室制二氧化碳的装置D.实验室制氯气的装置
2.实验室制取HCl气体的反应原理遵循了以下化学反应规律中的()
A.氧化还原反应原理
B.强酸制弱酸原理
C.难挥发性酸制取易挥发性酸
D.复分解反应原理
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是: ______ 。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,进行了以下实验。
(1)检验矿物样品中是否有Fe3+
实验用品:锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
实验步骤: ①取样:将样品用锤子敲碎,再在研钵中研细备用。
②溶解:将样品粉末倒入烧杯,加入___________,用玻璃棒充分搅拌。
③___________(填操作名称)。
④检验:取少许溶液,加入___________。实验现象:____________。
实验结论:矿物样品中含有Fe3+。
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)__________,反应的离子方程式是 ____________。
②同学们在新制得的亚铁盐溶液中加入适量的氢氧化钠溶液,制出的氢氧化亚铁呈__________色。为使试管中的氢氧化亚铁保存的时间更长,请在图中装置中加入什么物质_________。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.l mo1·L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
请回答:
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。乙方案中,说明HA是弱电解质的现象是
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中,难以实现之处是配制100mLpH=l的HA溶液;而不妥之处是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。
请回答:
(1) 生成的黑色(单质)物质是________(填化学式)。
(2) 这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是________(填名称),实验室经常用________溶液进行吸收,写出生成这种气体的化学方程式分别为:_______________________________
(3) 据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有_______________(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4) 将实验(2)产生的刺激性气味气体通入品红溶液,可以看到品红溶液________,加热后________。
(5) 能否用澄清石灰水鉴别这两种气体?____________(填“能”或“不能”)若不能填写两种能鉴别的试剂是________________________。
如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶中所装试剂为:B(碘化钾淀粉溶液)、C(紫色石蕊试液)、D(FeCl2溶液)、E(水)。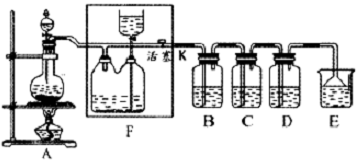
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为________________。
(2)F装置的作用为_____________;F装置瓶内宜加入的液体是________________。
(3)实验开始后B中的现象是_______________,C中的现象是________________。
(4)写出D中反应的化学方程式:__________________________________________。
(5)用量筒量取20 mL E中溶液,倒入已检漏的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是_____________(填“上层液”或“下层液”),再装入烧杯中,能使有色布条褪色的是_____________(填“上层液”或“下层液”)。