用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.l mo1·L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
请回答:
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。乙方案中,说明HA是弱电解质的现象是
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中,难以实现之处是配制100mLpH=l的HA溶液;而不妥之处是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
[化学]三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_____________。筒述你的理由
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为__ _,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,
请选出你认为的最佳途径 说明选择的理由 。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。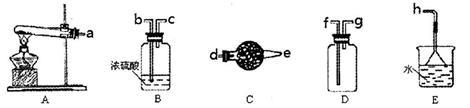
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h;用A装置制取NH3的化学反应方程式为 .
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________ (选填字母编号);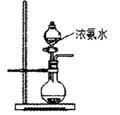
| A.碱石灰 |
| B.生石灰 |
| C.无水氯化钙 |
| D.无水硫酸铜 |
E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 。
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑ + 2H2O)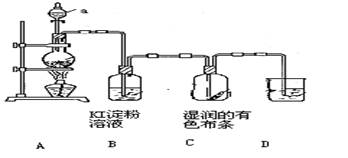
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是 。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 溶液。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④ ⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。